
下列实验现象所对应的离子方程式不正确的是
选项 | 实 验 | 现 象 | 离子方程式 |
A |
| 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2===2I2+2H2O |
B |
| 溶液由浅绿色变为红色 | 2Fe2++Cl2===2Fe3++2Cl-、 Fe3++3SCN-===Fe(SCN)3 |
C |
| 溶液由黄绿色变为无色 | Cl2+2OH-===Cl-+ClO-+H2O |
D |
| 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++ |
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源:2015-2016学年山西省太原市高一上学期阶段测化学试卷(解析版) 题型:选择题
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于阴影部分的是
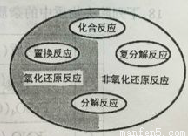
A.2H2+O2 =2H2O
B.CaCO3  CO2↑+CaO
CO2↑+CaO
C.Zn + FeSO4=ZnSO4+H2↑
D.CO+CuO CO+CuO
CO+CuO
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上学期期中理综化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是
A.已知H2(g)+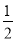 O2(g)=H2O(g);△H=-241.8 kJ·mol—1,则氢气的燃烧热为241.8 kJ·m
O2(g)=H2O(g);△H=-241.8 kJ·mol—1,则氢气的燃烧热为241.8 kJ·m ol—1
ol—1
B.已知C(石墨,s)=C(金刚石,s); △H= +1.9 kJ·mol—1,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.3 kJ· mol—1,则含1mol NaOH的稀溶液与1mol的稀醋酸完全中和,放出的热量也等于57.3kJ
D.已知2C(s)+2O2(g)=2CO2(g)) △H=a kJ·mol—1、 2C(s)+O2(g)=2CO(g) △H=b kJ· mol—1,则a>b
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省襄阳市四校高二上学期期中联考化学试卷(解析版) 题型:填空题
(1)1.00g CH4完全燃烧生成液态水和CO2,放出55.6 kJ热量,写出表示CH4的燃烧热的热化学方程式 。
(2)等物质的量浓度的下列溶液:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl ④NH4Fe(SO4)2中 ,c(NH4+)由大到小的顺序为 。
(3)写出符合要求的方程式
①饱和的FeCl3溶液滴入沸水中 (写离子方程式)
②NaHCO3在水溶液中存在的所有电离过程
(4)某温度下的溶液中,c(H+)=10x mol•L?1,c(OH-)=10y mol•L?1。x与y的关系如图所示:

①该温度下,NaCl溶液的pH= 。
②该温度下,pH=8的Ba(OH)2溶液与pH=6的盐酸混合,并保持恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。(忽略溶液混合时体积变化)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期9月教学质检化学试卷(解析版) 题型:选择题
用某种仪器量取液体体积时,平视时读数为nmL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为
A.量筒 B.容量瓶 C.滴定管 D.以上均不对
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列关于钠的说法不正确的是
A.金属钠与O2反应,条件不同,产物不同
B.钠—钾合金通常状况下呈液态,可作原子反应堆的导热剂
C.钠的化学活泼性很强,少量的钠可保存在煤油中
D.将金属钠投入水中,生成氢氧化钠,同时放出O2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高二上学期期中测试化学试卷(解析版) 题型:选择题
验证某有机物是否属于烃,应完成的实验内容是
A.只测定它的C、H比
B.只要证明它完全燃烧后产物只有H2O和CO2
C.只测定其燃烧产物中H2O与CO2的物质的量的比值
D.测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省沭阳县高一上学期期中测试化学试卷(解析版) 题型:选择题
取软锰矿石(主要成分为MnO2)116g 跟足量浓盐酸发生如下反应(杂质不参与反应)MnO2+4HCl(浓) 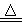 MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
MnCl2+Cl2↑+2H2O,制得22.4L Cl2(标准状况)。下列有关说法中不正确的是
A.这种软锰矿石中MnO2的质量分数为75%
B.被氧化的HCl的物质的量为4mol
C.参加反应的HCl的质量为146g
D.被还原的MnO2的物质的量为1mol
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江苏省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列事实不能用勒夏特列原理解释的是
A.溴水中有下列平衡Br2+H2O HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.反应CO(g)+NO2(g) CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深
D.对于2HI(g) H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com