
| A. | 溶液的pH | B. | 醋酸的电离常数 | ||
| C. | 中和时所需NaOH的量 | D. | 溶液中的c(CH3COOH) |
分析 醋酸为弱电解质,醋酸的浓度越大,则电离程度越小,但是溶液中氢离子浓度越大;中和时消耗的强氧化钠的物质的量取决于醋酸的物质的量,据此进行判断.
解答 解:A.酸的浓度越大,c(H+)越大,pH越小,前者氢离子浓度小,所以pH前者大于后者,故A正确;
B.醋酸的电离常数只与温度有关,温度相同,电离常数相同,故B错误;
C.计算两溶液中醋酸的物质的量,n(前)=c1•V1=0.1 L×0.01 mol•L-1=1×10-3 mol,n(后)=c2•V2=0.01 L×0.1 mol•L-1=1×10-3 mol,两者相等,因而中和时消耗的NaOH的量相等,故C错误;
D.由n=cV可知,100mL 0.01mol/L的醋酸溶液中溶质的物质的量为0.001mol,10mL0.1mol/L的醋酸溶液中溶质的物质的量为0.001mol,但前者浓度小,电离程度大,前者的CH3COOH的物质的量小,故D错误;
故选A.
点评 本题考查弱电解质的电离平衡及其影响,题目难度不大,注意把握弱电解质的电离特点,明确醋酸浓度越大、电离程度越小是解题的关键.


 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源:2016-2017学年陕西省高一上第一次月考化学卷(解析版) 题型:计算题
把5.3%的Na2CO3溶液蒸发掉60g水后,溶液变为20mL,浓度变为15.9%,则浓缩后Na2CO3溶液的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在CH3COONa溶液中通入SO2,生成CH3COOH | |
| B. | 等浓度的盐酸、CH3COOH溶液分别和锌反应,开始时盐酸的反应速率快 | |
| C. | 常温下0.1 mol•L-1 CH3COOH溶液的pH=2.1 | |
| D. | 用CH3COOH溶液做导电实验,灯泡很暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
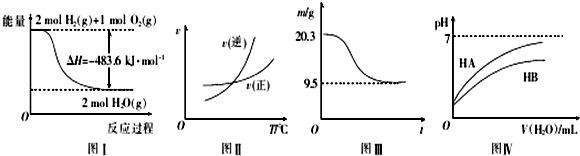
| A. | 图I表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H=-241.8 kJ.mol-1 | |
| B. | 图Ⅱ表示某可逆反应正、逆反应速率随温度的变化,则该反应的正反应是放热反应 | |
| C. | 图Ⅲ表示0.1 mol MgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| D. | 图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
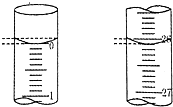 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com