
【题目】常温下,向0.1mol/L的H2SO4溶液中逐滴加入0.1mol/L的Ba(OH)2溶液,生成沉淀的质量与加入Ba(OH)2溶液的体积关系如图所示,下列说法中正确的是( ) 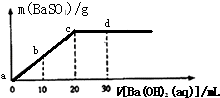
A.a﹣d溶液的pH:a<b<c<d
B.a﹣d溶液的导电能力:a<b<c<d
C.b处溶液的c(H+)与d处溶液的c(OH﹣)相等
D.c处溶液和d处溶液均呈碱性
【答案】A
【解析】解:A、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,随着氢氧化钡溶液的加入,溶液中氢离子的浓度逐渐降低,溶液的PH 值逐渐增大,当达到c点时,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液的PH=7,继续滴加氢氧化钡溶液,溶液的PH>7,故A正确.B、导电能力与溶液中自由移动离子的浓度有关,离子浓度越大,导电能力越强,随着氢氧化钡溶液的加入,溶液中硫酸根离子和氢离子逐渐减少,当达到c点时,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液的导电性最小,继续滴加氢氧化钡溶液时,氢氧化钡是可溶性的强电解质,溶液中自由移动的离子浓度增大,导电性逐渐增强,所以导电能力是先减小后增大,故B错误.
C、硫酸和氢氧化钡的反应方程式为H2SO4+Ba(OH)2=BaSO4↓+2H2O,溶液混合前硫酸的物质的量浓度和氢氧化钡的物质的量浓度相同,根据图象知,滴加氢氧化钡溶液20mL时,两种溶液恰好反应,所以硫酸的体积为20mL,b点时,氢离子的物质的量浓度= ![]() =
= ![]() mol/L;d点时氢氧根离子的物质的量浓度=
mol/L;d点时氢氧根离子的物质的量浓度= ![]() =
=![]() mol/L,所以两处的物质的量浓度不同,故C错误.
mol/L,所以两处的物质的量浓度不同,故C错误.
D、c处,硫酸和氢氧化钡恰好反应生成硫酸钡和水,溶液呈中性;d处氢氧化钡溶液过量导致溶液呈碱性,故D错误.
故选A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 氯化铝溶液与过量的氨水反应:Al3++4NH3·H2O===AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
B. 小苏打溶液中加入过量的澄清石灰水:Ca2++2OH-+2HCO![]() ===CaCO3↓+ CO
===CaCO3↓+ CO![]() +2H2O
+2H2O
C. 纯碱溶液中滴加少量盐酸:CO32-+H+===HCO![]()
D. 用FeCl3溶液腐蚀铜电路板:Fe3++ Cu === Fe2++ Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2 (SO4 )3 、K2 SO4 和明矾的混合溶液中,如果c(SO4 2- )等于0.2 mol/L,当加入等体积的0.2 mol/L 的KOH溶液时,生成的沉淀恰好溶解,则原混合溶液中K + 的物质的量浓度为
A. 0.2 mol/L B. 0.25 mol/L C. 0.45 mol/L D. 0.225 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于阿伏伽德罗常数NA , 下列叙述正确的是( )
A.标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA
B.1.0L0.1 molL﹣1 AlCl3溶液中所含的Al3+离子数为0.1NA
C.标准状况下,11.2LSO3中含有分子数目为0.5NA
D.常温常压下,3.2gO2和O3混合气体中含有的氧原子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化反应和还原反应描述正确的是
A.Na2O2、Na分别与H2O反应时,H2O都只发生还原反应
B.Zn、Cl2分别与FeCl2反应时,FeCl2都只发生还原反应
C.原电池的负极与电解池的阴极都只发生氧化反应
D.氧化反应和还原反应一定同时发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列装置或操作描述正确的是( )
A.
图中若A为醋酸,B为贝壳,C为苯酚钠溶液,则可验证醋酸的酸性大于碳酸,但不能验证碳酸的酸性大于苯酚
B.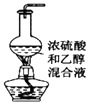
图用于实验室制乙烯
C.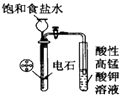
图用于实验室制乙炔并验证乙炔可以发生氧化反应
D.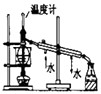
图用于实验室中分馏石油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑, 蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指
A. 萃取B. 过滤C. 分液D. 蒸馏
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com