
| A. | 食盐溶化 | B. | 干冰升华 | ||
| C. | 氯化铵受热,固体消失 | D. | 石墨熔化 |
分析 先判断断键方式,再判断克服的作用力,只需克服分子间作用力,则晶体为分子晶体,且未发生化学键断裂.
A.氯化钠属于离子晶体,氯化钠晶体熔化破坏化学键;
B.干冰属于分子晶体,升华属于物质的状态变化;
C.氯化铵受热,生成氯化氢和氨气,生成新物质,破坏化学键;
D.石墨属于混合型晶体,熔化过程中共价键破坏.
解答 解:A.氯化钠属于离子晶体,氯化钠晶体熔化破坏化学键,离子键破坏,而不是分子间作用力,故A错误;
B.干冰属于分子晶体,升华属于物质的状态变化,克服了分子间作用力,故B正确;
C.氯化铵受热,生成氯化氢和氨气,生成新物质,破坏化学键,而不是分子间作用力,故C错误;
D.石墨属于混合型晶体,熔化过程中层内共价键破坏,而层之间分子间作用力破坏,所以不只是克服分子间作用力,故D错误;
故选B.
点评 本题考查物质的成键方式,此类题的解题方法是:先判断断键方式,再判断克服的作用力,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
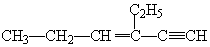 ,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )
,分子中含有四面体结构的碳原子数为a,在同一直线上的碳原子数为b,在同一平面内的碳原子数最多为c,则a、b、c分别为( )| A. | 4、3、6 | B. | 4、3、8 | C. | 2、5、4 | D. | 4、4、6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
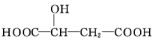 ,下列说法正确的是( )
,下列说法正确的是( )| A. | 苹果酸不能发生聚合反应 | |
| B. | 1 mol苹果酸与足量金属Na反应生成1 mol H2 | |
| C. | 苹果酸分子的核磁共振氢谱有四组峰,峰面积之比为1:1:2:2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Q1>Q2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1 mol HCl气体时放出Q1 kJ热量 | |
| D. | 1 mol HBr(g)具有的能量小于1 mol HBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
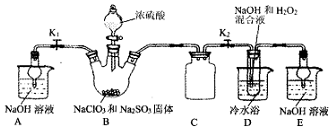
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X<Y<Z<W | |
| B. | Z的氢化物中只含离子键 | |
| C. | 最高价氧化物对应水化物的酸性:Y<W | |
| D. | X和W两种元素形成的化合物,既能与强酸反应又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: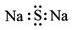 | B. | 中子数为10的氧原子:${\;}_8^{10}O$ | ||
| C. | 硫离子的结构示意图: | D. | HC1O的结构式:H-O-Cl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com