
| A. | ①④⑤ | B. | ②③④ | C. | ②③⑤ | D. | ①③④⑥ |
分析 胶体粒子的微粒直径在l~100nm之间,纳米碳其粒子直径为l~100nm之间,将纳米碳分子分散到水中,所形成的分散系为胶体分散系,利用胶体中分散质粒子的直径和胶体的性质来解答.
解答 解:①因纳米碳其粒子直径为l~100nm之间,纳米碳分子分散到水中,所形成的分散系为胶体分散系,不属于溶液,故①错误;
②因纳米碳其粒子直径为l~100nm之间,纳米碳分子分散到水中,所形成的分散系为胶体分散系,故②正确;
③因形成的是胶体分散系,则具有丁达尔效应,故③正确;
④溶液和胶体分散系中粒子的直径都比滤纸中小孔直径小,则能全部透过滤纸,故④错误;
⑤溶液和胶体分散系中粒子的直径都比滤纸中小孔直径小,则能全部透过滤纸,故⑤正确;
⑥因形成的是胶体分散系,处于介稳定状态,则不会形成黑色沉淀,故⑥错误;
故选C.
点评 本题考查胶体中胶体粒子的直径及胶体的性质,难度不大,学生能准确判断纳米碳分子分散到水中形成的分散系的种类是解答本题的关键.


科目:高中化学 来源: 题型:实验题
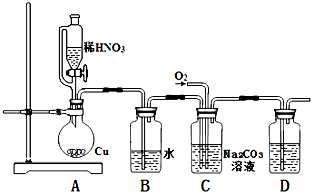 亚硝酸钠(NaNO2)是一种重要的工业盐,易潮解,易溶于水,微溶于乙醇.暴露于空气中会与氧气反应生成硝酸钠.
亚硝酸钠(NaNO2)是一种重要的工业盐,易潮解,易溶于水,微溶于乙醇.暴露于空气中会与氧气反应生成硝酸钠.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、B全部变成了C和D | B. | B的正反应速率和逆反应速率相等 | ||
| C. | 反应已经停止 | D. | A、B、C、D四种物质的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体熔点的高低: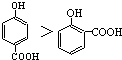 | |
| B. | 硬度由大到小:金刚石>碳化硅>晶体硅 | |
| C. | 熔点由高到低:Na>Mg>Al | |
| D. | 晶格能由大到小:NaF>NaCl>NaBr>NaI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变压强不一定改变反应速率 | |
| B. | 使用催化剂能同时增大正、逆反应的速率,并改变化学反应的限度 | |
| C. | 固体物质的状态(如块状、粉末状等)对反应速率有影响 | |
| D. | 升高温度一定能增大反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用铝热反应制得单质镁 | |
| B. | 从海带中提取碘常用过氧化氢做还原剂 | |
| C. | 水华、赤潮等水体污染是由于含氮、磷的大量污水任意排放造成的 | |
| D. | 铝热剂就是指铝和氧化铁混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 研究物质在水溶液中的反应,溶液是环境,盛溶液的烧杯和溶液之外的空气等便是体系 | |
| B. | 能源的开发和利用可以用来衡量一个国家或地区的经济发展和科学技术水平 | |
| C. | 催化剂能降低反应的活化能,使单位体积内活化分子百分数大大增加 | |
| D. | 在稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.5mol H2SO4的浓硫酸与含1mol KOH的溶液混合,放出的热量大于57.3kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com