
【题目】现有标准状况下V L 气体AB3,它的摩尔质量为M g·mol-1。则:
(1)该气体所含原子总数为________________个(列出计算式即可,下同)。
(2)该气体的质量为_____________g。
(3)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为______________。
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为_______________ mol·L-1。
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度为_____________________mol·L-1
【答案】 ![]() 个
个 ![]()
![]()
![]() mol·L-1
mol·L-1 ![]() mol·L-1
mol·L-1
【解析】试题分析:标准状况下V L 气体AB3的物质的量n(AB3)= ![]() mol,则m(AB3)=n(AB3)
mol,则m(AB3)=n(AB3) ![]() M(AB3)=
M(AB3)= ![]() mol
mol![]() M g·mol-1=
M g·mol-1=![]() g.
g.
(1)该气体所含分子总数N(AB3)= n(AB3) ![]() NA=
NA=![]() ,所含原子总数为分子总数的4倍,即
,所含原子总数为分子总数的4倍,即![]() 个。
个。
(2)该气体的质量为![]() g。
g。
(3)该气体溶于1L水中(不考虑反应),1L水的质量为1000g,其溶液中溶质的质量分数为![]() 。
。
(4)该气体溶于水后形成1 L溶液,其溶液的物质的量浓度为c(AB3)= ![]()
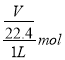 =
=![]() mol·L-1。
mol·L-1。
(5)该气体溶于1L水中(不考虑反应),若所得溶液的密度为ρg·mL-1,则溶液的物质的量浓度可以使用质量分数与物质的量浓度的转换公式,把前面求得的质量分数代入即可 ,c(AB3)= ![]() =
=![]() mol·L-1
mol·L-1


科目:高中化学 来源: 题型:
【题目】如右图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是
A.非金属性:F > S > Cl B.原子半径:Cl > S > F
C.稳定性:HF > HCl > H2S D.酸性:HClO4 > H2SO4
He | ||
F | ||
S | Cl | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于组成细胞的元素和化合物的叙述中,正确的是
A. 原核细胞与真核细胞遗传物质的碱基种类相同
B. 细胞中的能源物质包括糖类、脂质、蛋白质和核酸
C. 细胞中含量最稳定的物质是核酸,其元素组成是C、H、O、N、P、S
D. 蛋白质的功能多样性导致蛋白质结构的多样性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成 下列各小题。
(1)实验装置:
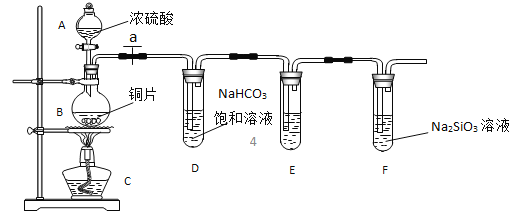
填写所示仪器名称 A_________B________________________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中足量酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________________________;
③依据试管 D 中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填 “能”或“否”),试管 D 中发生反应的离子方程式是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) == 2CO2(g)+2H2O(l) ΔH1=-870.3 kJ·mol-1
(2)C(s)+ O2(g) == CO2(g) △H2=-393.5 kJmol-1
(3)H2(g) +![]() O2(g) == H2O(l) △H3=-285.8kJ·mol-1
O2(g) == H2O(l) △H3=-285.8kJ·mol-1
则反应2C(s)+2H2(g) +O2(g) == CH3COOH(l)的△H为( )
A.-488.3 kJ·mol-1 B.-244.15 kJ·mol-1 C.+488.3 kJ·mol-1 D.+244.15 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
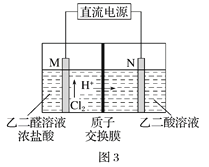
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组利用下图装置进行碱式碳酸钴[Cox(OH)y(CO3)z]的化学组成测定的探究实验,图中铁架台等装置已略去,粗黑线表示乳胶管。

已知碱式碳酸钴受热时按右式分解:碱式碳酸钴![]() 钴的氧化物+CO2↑+H2O↑。
钴的氧化物+CO2↑+H2O↑。
回答下列问题:
(l)按如图所示装置组装好仪器,在装药品前,应先进行的操作是_______。
(2)称取3.65g样品置于硬质玻璃管内;打开活塞a,缓缓通入空气数分钟,关闭活塞a;加热硬质玻璃管,当丙装置中不再有气泡产生时,停止加热;又打开活塞a,再缓缓通入空气数分钟。两次通入空气的目的不同,第一次的目的是将装置中含二氧化碳和水蒸气的空气排尽,第二次的目的是______。
(3)通过正确实验测得丙、丁装置增重分别为0.36g、0.88g,则该碱式碳酸钴的化学式为______。
(4)甲装置中X试剂是______(填标号)。
a.浓硫酸 b.水氯化钙 c.五氧化二磷粉末 d.碱石灰
(5)若去掉戊装置,会使x的值______(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com