

 HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O HClO+OH-;
HClO+OH-; 

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
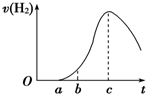 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 4 g CO2气体中所含原子数为2 NA |
| B、常温常压下,22.4 L氢气所含原子数为2 NA |
| C、1 L mo l?L-1的硫酸钠溶液中钠离子数为2 NA |
| D、在Cl2参与的反应中,1 mol Cl2得到的电子数一定是2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、键角的大小与键长、键能的大小无关 |
| B、键长的大小与成键原子的半径和成键数目有关 |
| C、键角是描述分子立体结构的重要参数 |
| D、键能越大,键长越长,共价化合物越稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3属于碳酸盐 |
| B、盐酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| C、蓝矾(CuSO4?5H2O)和干冰属于化合物,铁矿石属于混合物 |
| D、通过化学反应,可由Ba(OH)2一步转化生成NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
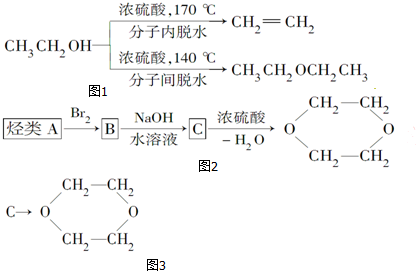
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、增加铁片的用量 |
| B、将2 mol?Lˉ1的硫酸改为98%的硫酸 |
| C、再加入10 mL 2 mol?Lˉ1的硫酸 |
| D、将铁片粉碎 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | A | B | C | D |
| n(CO2)(mol) | 2 | 3 | 4 | 5 |
| n(沉淀)(mol) | 2 | 2 | 3 | 3 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com