
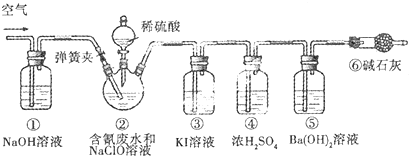

分析 处理含氰废水,并测定含氰废水的处理百分率实验的原理是:利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定⑤的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率.根据装置中试剂的性质推测装置的位置;装置①吸收空气中二氧化碳,排除空气中的二氧化碳对实验的干扰,装置②产生二氧化碳,装置③的作用是吸收装置②中可能产生的Cl2,防止对装置⑤实验数据的测定产生干扰,装置④对产生的二氧化碳进行干燥,根据关系式计算含氰废水处理百分率,装置⑥的作用是排除空气中二氧化碳对实验的干扰,排除空气中二氧化碳对实验的干扰.
(1)NaCN属于离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子;
(2)氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,依据原子守恒书写化学方程式;
(3)①反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
②实验中观察到三颈烧瓶上方有黄绿色气体,说明生成了氯气,则装置③的现象是氯气氧化碘离子生成碘单质,溶液变为褐色;
③实验中应排除空气中二氧化碳的干扰;
④实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,
通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,;
(4)用石墨作阳极,铁板作阴极,在碱性废水中加入氯化钠进行电解,当氯化钠投加量较少时,则以氯化钠为导电介质,主要依靠阳极的氧化作用,使CN-在阳极上放电,当氯化钠投加量较多时,则利用Cl-在阳极上放电的产物将CN-氧化,氯化钠较多时阳极区发生的电极反应为氯离子失电子生成氯气,氯气在碱溶液中将CN-氧化生成碳酸盐和氮气,氯气被还原为氯离子,结合电荷守恒、原子守恒配平书写离子方程式.
解答 解:(1)NaCN为离子化合物,电子式为 ,故答案为:
,故答案为: ;
;
(2)氰化氢与双氧水反应生成两种无毒气体为氮气和二氧化碳,反应的化学方程式为:2HCN+5H2O2=N2+2CO2+6H2O,
故答案为:2HCN+5H2O2=N2+2CO2+6H2O;
(3)①反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置⑤,以减少实验误差,
故答案为:使装置中残留的二氧化碳全部进入装置⑤完全吸收;
②实验中观察到三颈烧瓶上方有黄绿色气体,说明生成了氯气,则装置③的现象是氯气氧化碘离子生成碘单质,Cl2+2I-=I2+2Cl-,碘单质溶于水溶液变为褐色,
故答案为:溶液变为褐色;
③实验中应排除空气中二氧化碳的干扰,防止对装置⑤实验数据的测定产生干扰,装置①和⑥的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和H2O进入装置⑤,产生误差;
④实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定装置⑤的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,若已知该装置反应前后质量变化为0.8g,物质的量=$\frac{0.8g}{44g/mol}$=$\frac{0.2}{11}$mol,将CN-的浓度为0.2000mol/L的含氰废水100mL与100mL NaClO溶液(过量)置于装置②三颈烧瓶中充分反应,CN-物质的量=0.2000mol/L×0.100L=0.02mol,
CN-~CNO~CO2
实验中测得CN-被处理的百分率=$\frac{\frac{0.2}{11}}{0.02}$×100%=90.9%,
故答案为:装置⑤;90.9%;
(4)用石墨作阳极,铁板作阴极,在碱性废水中加入氯化钠进行电解,当氯化钠投加量较少时,则以氯化钠为导电介质,主要依靠阳极的氧化作用,使CN-在阳极上放电,当氯化钠投加量较多时,则利用Cl-在阳极上放电的产物将CN-氧化,氯化钠较多时阳极区发生的电极反应为氯离子失电子生成氯气,氯气在碱溶液中将CN-氧化生成碳酸盐和氮气,氯气被还原为氯离子,2Cl--2e-=Cl2↑,结合电荷守恒、原子守恒配平书写离子方程式为:5Cl2+2CN-+12OH-=2CO32-+N2↑+10Cl-+6H2O,
故答案为:2Cl--2e-=Cl2↑,5Cl2+2CN-+12OH-=2CO32-+N2↑+10Cl-+6H2O.
点评 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 新制的氯水保存在棕色广口瓶中,并放在阴凉处 | |
| B. | 溴水存放在带玻璃塞的无色试剂瓶中 | |
| C. | 烧碱溶液放在带玻璃塞的磨口试剂瓶中 | |
| D. | 金属钠保存在煤油中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5mol•L-1•mim-1 | B. | v(B)=0.3mol•L-1•mim-1 | ||
| C. | v(C)=0.8mol•L-1•mim-1 | D. | v(D)=0.1mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ②③④ | C. | ②⑧ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生物柴油具有良好的燃料性能,属于烃类,安全、环保、可再生 | |
| B. | 油脂是人类维持生命活动所需能量的主要来源 | |
| C. | PM2.5是指空气中氮氧化物和硫氧化物含量之和 | |
| D. | 登高山时防晒是为了防止强紫外线引起皮肤蛋白质被灼伤变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
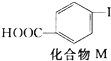 +CH2═CH2$\stackrel{一定条件}{→}$
+CH2═CH2$\stackrel{一定条件}{→}$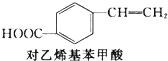 +HI
+HI| A. | 对乙烯基苯甲酸的分子式为C9H10O2 | |
| B. | 对乙烯基苯甲酸的同分异构体共有三种 | |
| C. | 对乙烯基苯甲酸既属于羧酸,又属于烯烃 | |
| D. | 二者均可发生取代反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
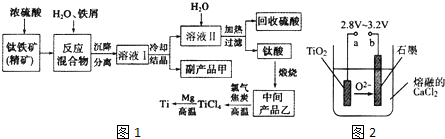
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-14 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质变化 | 能量关系 | |
| A | 将充满NO2的针筒置于热水中,气体颜色变深 | 1molN2O4(g)的能量>2molNO2(g)的能量 |
| B | 将NaOH溶液与HCl溶液混合 | 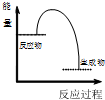 |
| C | 1g气态SiH4在空气中燃烧,生成SiO2 (s)与液态水,放热44.6kJ | SiH4(g)+2O2(g)→SiO2(s)+2H2O(l)+44.6kJ |
| D | 合成氨:N2(g)+3H2(g)?2NH3(g)+92.4kJ | 反应物的总键能>生成物的总键能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
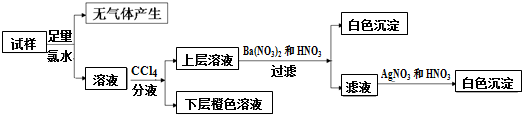
| A. | 若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响 | |
| B. | 无法确定原溶液中是否存在Cl- | |
| C. | 肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定 | |
| D. | 肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com