

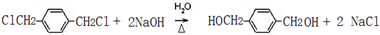 .
.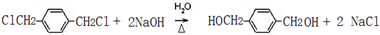 ;
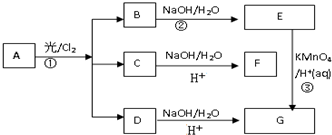
;分析 A是一种分子量是106的烃,则$\frac{106}{12}$=8…10,可知A的分子式为C8H10,在核磁共振氢谱中出现两种峰,其氢原子个数之比为3:2,则A为 ,A与氯气在光照条件下发生甲基上取代反应得到B、C、D,B水解得到E的化学式是C8H10O2,则B为
,A与氯气在光照条件下发生甲基上取代反应得到B、C、D,B水解得到E的化学式是C8H10O2,则B为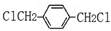 、E为
、E为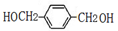 ,E氧化生成G为
,E氧化生成G为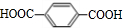 ,D水解后酸化得到G,故G为
,D水解后酸化得到G,故G为 .
.
解答 解:A是一种分子量是106的烃,则$\frac{106}{12}$=8…10,可知A的分子式为C8H10,在核磁共振氢谱中出现两种峰,其氢原子个数之比为3:2,则A为 ,A与氯气在光照条件下发生甲基上取代反应得到B、C、D,B水解得到E的化学式是C8H10O2,则B为
,A与氯气在光照条件下发生甲基上取代反应得到B、C、D,B水解得到E的化学式是C8H10O2,则B为 、E为
、E为 ,E氧化生成G为
,E氧化生成G为 ,D水解后酸化得到G,故G为
,D水解后酸化得到G,故G为 .
.
(1)反应①、②、③的反应类型分别是取代反应、取代反应、氧化反应,
故答案为:取代反应、取代反应、氧化反应;
(2)下列关于E( )的说法:
)的说法:
a.分子中含有3种H原子,核磁共振氢谱有3个峰,故a正确;
b.不能发生消去反应,故b错误;
c.不含酚羟基,不能与FeCl3溶液反应产生紫色,故c错误;
d.醇羟基不如水活泼,能与Na反应比水与钠反应慢,故d错误;
e.可以与氢气发生加成反应,属于还原反应,故e正确,
故选:ae;
(3)B→E反应的化学方程式: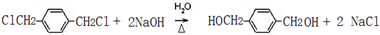 ,
,
故答案为: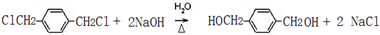 ;
;
(4)生成物F中取代基可能为-CH2OH、-CHO、-COOH,相互组合形成9种物质,包含E、G,故F的可能结构有7种,
故答案为:7.
点评 本题考查有机物的推断,关键是确定A的结构简式,结合E的分子式进行推断,熟练掌握官能团的性质与转化,注意碳原子碳原子连接多个羟基时不稳定会自动脱水.


科目:高中化学 来源: 题型:选择题
| A. | 用新制氢氧化铜检验牙膏中的甘油,现象是看到产生蓝色沉淀 | |
| B. | 为了使过饱和溶液中析出晶体,可用玻璃棒摩擦与溶液接触处的试管壁 | |
| C. | 做银镜反应实验后,试管内壁上的附着物用稀硝酸洗涤 | |
| D. | 用纸层析法分离Fe3+、Cu2+时,滤纸上的水做固定相,氨气做显色剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
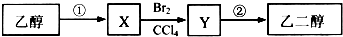
| A. | 步骤①的反应类型是氧化反应 | |
| B. | 等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的量相同 | |
| C. | 1 mol乙二醇与乙酸若完全发生酯化反应,理论上可以增重120g | |
| D. | X可以使酸性高锰酸钾溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.2mol | B. | 1mol | C. | 1.6mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
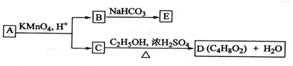
| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有NO2和Cl2 | B. | 一定有SO2 和NO | ||
| C. | 可能有NO2 | D. | 一定有SO2,可能有NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
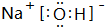 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳-14核素:${\;}_8^{14}C$ | B. | Ca2+的结构示意图为  | ||
| C. | 氮气的电子式 | D. | HCIO的结构式为H-Cl-O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
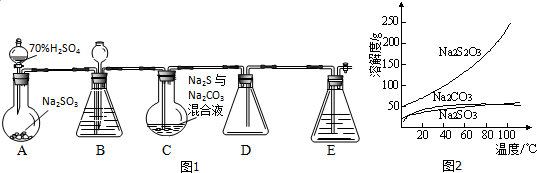
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com