
| A | B | C | D |
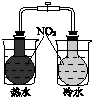 | 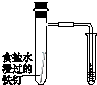 | 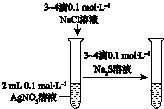 | 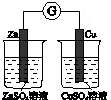 |
| 验证温度对平 衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S | 验证化学能 转化为电能 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.存在2NO2?N2O4,由图可知温度高颜色深;
B.食盐水显中性,发生吸氧腐蚀;
C.硝酸银过量,发生沉淀的生成,而不是转化;
D.没有构成闭合回路.
解答 解:A.存在2NO2?N2O4,由图可知温度高颜色深,可知温度高平衡逆向移动,则验证温度对平衡移动的影响,故A正确;
B.食盐水显中性,发生吸氧腐蚀,不能发生析氢腐蚀,故B错误;
C.硝酸银过量,发生沉淀的生成,而不是转化,则不能比较溶解度,故C错误;
D.没有构成闭合回路,不能构成原电池,则不能实现能量转化,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及温度对平衡的影响、电化学腐蚀、沉淀的生成和转化、原电池原理等,把握反应原理为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析及实验装置的作用,题目难度中等.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
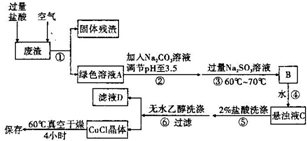 通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.
通常情况下,CuCI为白色粉末,微溶于水,不溶于乙醇,常用作有机合成的催化剂,并用于颜料、防腐等工业.CuCI露置于空气中较易被氧化为绿色的高价铜盐,见光易分解,变成褐色,受潮易变成蓝到棕色.有机硅装置在单体合成的生产过程中,副产高沸物、共沸物、硅渣浆液.其中硅渣浆液中含有Si、Cu及有机硅单体等物质,硅渣浆液经过处理后可得到富含硅、铜、碳的废渣.如图是从废渣中制取CuCI的一种工艺流程图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯水振荡,观察水层是否有棕红色溴出现 | |
| B. | 滴入AgNO3溶液,再加入稀硝酸呈酸性,观察有无浅黄色沉淀生成 | |
| C. | 加入NaOH溶液共热,然后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 | |
| D. | 加入NaOH溶液共热,冷却后加入AgNO3溶液,观察有无浅黄色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图为牺牲阳极的阴极保护法,可以防止铁棒被腐蚀 | |
| B. |  图所示装置可以检验溴乙烷与NaOH醇溶液共热产生的乙烯 | |
| C. |  图所示装置可以用来制备氢氧化亚铁 | |
| D. |  图所示装置可以用来测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类依据 | 类别 | 有机化合物序号 |
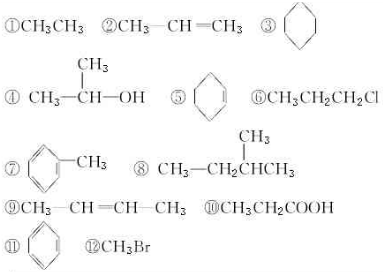
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
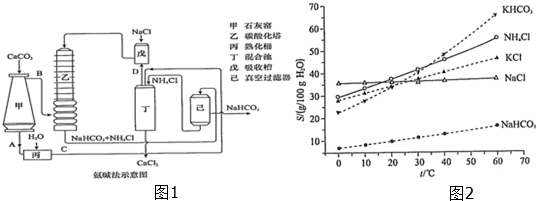
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com