
| A. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| B. | 常温常压下的67.2L氯气与27g铝充分反应,转移电子数为3NA | |
| C. | 1L 1mol/L的稀硝酸中,含氧原子数为3NA | |
| D. | 1molCO和CO2混合气体中含C原子数为NA |
分析 A.过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移0.2mol电子;
B.常温常压下是24.5mol/L,67.2L氯气的物质的量约为:$\frac{67.2L}{22.5L/mol}$≈2.99mol,27g铝的物质的量为1mol,则氯气过量,1mol铝完全反应转移3mol电子;
C.稀硝酸中,溶剂水分子中也含有O原子;
D.1molCO和CO2混合气体中含有1molC.
解答 解:A.过氧化钠与水反应时,过氧化钠中氧元素的化合价为-1价,则生成0.1mol氧气转移转移0.2mol电子,转移的电子数为0.2NA,故A正确;
B.常温常压下67.2L氯气的物质的量约为:$\frac{67.2L}{22.5L/mol}$≈2.99mol,27gAl的物质的量为1mol,1mol铝完全反应消耗1.5mol氯气,显然氯气过量,1mol铝完全反应失去3mol电子,转移电子数为3NA,故B正确;
C.1L 1mol/L的稀硝酸中含有1mol硝酸,1mol硝酸中含有3molO原子,由于水分子中也含有O原子,则该溶液中含氧原子数大于3NA,故C错误;
D.1molCO和CO2混合气体中含有1molC原子,含C原子数为NA,故D正确;
故选C.
点评 本题考查阿伏加德罗常数的计算与判断,题目难度中等,注意熟练掌握物质的量与其它物理量之间的关系,C为易错点,注意水分子中含有O原子,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:填空题
 .
.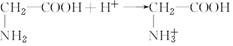 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
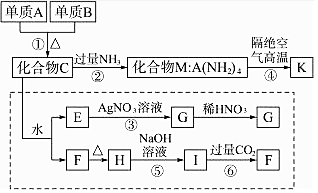 材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性,它是以中学化学中的常见物质为原料来生产的.如图所示为其生产过程,其中虚线框内转化是为探究C的组成而设.已知A、B均为非金属单质,G、F、H均难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质:
材料科学是近年来与化学有关的科学研究的重点,某新型无机非金属材料K由两种非金属元素组成,它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化等特性,它是以中学化学中的常见物质为原料来生产的.如图所示为其生产过程,其中虚线框内转化是为探究C的组成而设.已知A、B均为非金属单质,G、F、H均难溶于水且为白色粉末;图中除M、K(均含A元素)外均为中学化学常见物质:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.5 mol•L-1•s-1 | B. | v(B)=0.3 mol•L-1•s-1 | ||
| C. | v(C)=0.8 mol•L-1•s-1 | D. | v(D)=1.0 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①③ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaCl固体 | |
| B. | 用25mL酸式滴定管量取15.80mL盐酸溶液 | |
| C. | 用10mL量筒量取8.50mL盐酸 | |
| D. | 用广泛pH试纸测得某溶液pH值为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
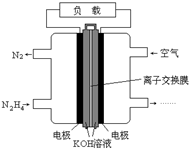 液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点.一种以肼(N2H4)为燃料的电池装置如图所示.该电池用空气中的氧气作为氧化剂,KOH作为电解质.下列关于该燃料电池的叙述正确的是( )| A. | 电子从右侧电极经过负载后流向左侧电极 | |
| B. | 负极发生的电极反应式为:N2H4-4e-=N2+4H+ | |
| C. | 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 | |
| D. | 该燃料电池持续放电时.K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省德州市高二上10月月考化学试卷(解析版) 题型:选择题
某同学按图所示的装置进行电解实验。下列说法不正确的是( )
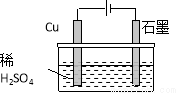
A.电解过程中,铜电极上有H2产生
B.电解初期,主反应方程式为:
Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度会减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com