
【题目】以下为工业从海水中提取液溴的流程图:
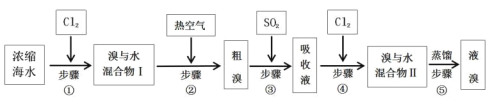
(1)当进行步骤①时,应关闭活塞_______,打开活塞____________。
已知:溴的沸点为 59 ℃,微溶于水,有毒性。某同学利用下图装置进行步骤①至步骤④的实验,请回答:
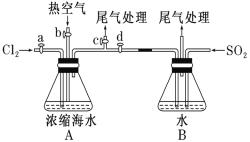
(2)步骤②中可根据_____________现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是_____________。
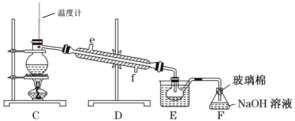
(4)步骤⑤用下图装置进行蒸馏。装置 C 中直接加热不合理,应改为______,蒸馏时冷凝水应从______端进入(填“e”或“f”), F 的作用是________。
【答案】bd ac A中气泡冒出的个数(或快慢) B中溶液橙色刚好褪去 水浴加热 f 吸收溴蒸气,防止污染空气
【解析】
由流程图可知,向浓缩海水中通入氯气,氯气与海水中溴离子发生置换反应得到溴与水的混合物,利用热的空气吹出溴单质,得到粗溴,向粗溴溶液中通入二氧化硫,二氧化硫与溴单质发生氧化还原反应得到含有溴化氢和硫酸的吸收液,再向吸收液中通入氯气,氯气与溴化氢发生置换反应得到溴与水的混合物,蒸馏溴与水的混合物得到液溴。
(1)进行步骤①的目的是通入氯气,氯气与海水中溴离子发生置换反应得到溴与水的混合物,实验时应关闭bd,打开ac,进行反应和尾气处理,故答案为:bd;ac;
(2)步骤②是通入热空气把生成的溴单质赶到装置B得到粗溴溶液,和通入的二氧化硫发生氧化还原反应,实验时关闭ac,打开bd,依据A中玻璃管产生气泡的快慢判断热空气的流速,故答案为:A中玻璃管产生气泡的快慢;
(3)步骤③中是二氧化硫与溴单质发生氧化还原反应得到含有溴化氢和硫酸,溴水褪色,则简单判断反应完全的依据是B中溶液橙色刚好褪去,故答案为:B中溶液橙色刚好褪去;
(4)蒸馏时,因溴的沸点低于水的沸点,为使烧瓶均匀受热,避免温度过高,装置C中加热方式应改为水浴加热;为增强冷凝效果,冷凝管中的水应从下口f进入;因溴易挥发,有毒,装置F中氢氧化钠溶液的作用是吸收溴蒸气,防止污染空气,故答案为:水浴加热;f;吸收溴蒸气,防止污染空气。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒压密闭容器M(如图Ⅰ)和恒温恒容密闭容器N(如图Ⅱ)中,两容器中均加入a molA和a molB,起始时两容器体积均为VL,发生如下反应并达到化学平衡状态:2A(?)+ B(?)![]() xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是
xC(g) ΔH<0,平衡时M中A、B、C的物质的量之比为1∶3∶4。下列判断不正确的是

A. x=2
B. 若N中气体的密度如图Ⅲ所示,则A、B只有一种是气态
C. A为气体,B为非气体,则平衡时M、N中C的物质的量相等
D. 若A、B均为气体,平衡时M中A的转化率小于N中A的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,左侧注射器吸入10mLNO2、N2O4的混合气体,右侧注射器吸入10mL空气,且U型管内两侧液面保持水平位置(液体不与气体反应),现将两侧注射器活塞同时快速向内推到5mL,下列说法不正确的是(忽略温度变化)

(1)当活塞迅速向里推时,气体的颜色先变_________,后变_________;最终和最初相比,_________更深,平衡向____________移动,NO2体积分数_______________
(2)压缩后U型管内左侧液面_______,右侧液面___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.镀铜铁制品镀层破坏后,铁制品更易发生腐蚀
B.使用催化剂既能改变反应速率,又能改变焓变
C.其他条件不变时,升高温度,吸热反应的v正增大,v逆减小
D.工业电解精炼铜时,粗铜与电源的负极相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如右图所示),与白磷分子相似。已知断裂 1 mol N—N键吸收193 kJ热量,断裂 1 mol N≡N键吸收941 kJ热量,则

A. N4与N2互称为同位素
B. 1 mol N4气体转化为N2时要吸收724 kJ能量
C. N4是N2的同系物
D. 1 mol N4气体转化为N2时要放出724 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固定容积的密闭容器中进行如下反应:2SO2(g)+O2(g) ![]() 2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
2SO3(g),已知反应过程某一时刻SO2、O2、SO3浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L,达到平衡时浓度可能正确的是
A. SO2、O2分别为0.4 mol/L、0.2 mol/L B. SO2为0.25 mol/L
C. SO2、SO3均为0.15 mol/L D. SO2为0.24 mol/L,SO3为0.14 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁盐、铁盐在工农业生产、生活、污水处理等方面有着极其广泛的应用,现用铁屑与硫酸反应制备硫酸亚铁。
已知:①4Fe2++O2+4H+===4Fe3++2H2O
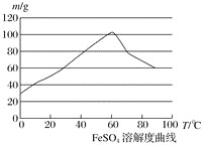
②硫酸亚铁在水中的溶解度如下图:
(1)首先,将铁屑放入碳酸钠溶液中煮沸除油污,分离出液体,用水洗净铁屑。此步骤中,分离出液体的方法通常不用过滤,使用的操作是____________(填写操作名称)。
(2)向处理过的铁屑中加入适量的硫酸,在一定温度下使其反应到不再产生气体,趁热过滤,得硫酸亚铁溶液。
①硫酸浓度应选择(填字母序号)__________;
A.浓硫酸 B.10 moL·L-1硫酸
C.3 moL·L-1硫酸 D.任意浓度硫酸
②温度宜控制在________,加热的同时需适当补充水,原因是___________________;
③反应中应保持![]() _________ (填“<”“>”或“=”) 1。
_________ (填“<”“>”或“=”) 1。
(3)亚铁盐在空气中易被氧化,但形成复盐可稳定存在,如“摩尔盐”,即(NH4)2SO4·FeSO4·6H2O(硫酸亚铁铵),就是在硫酸亚铁溶液中加入少量稀硫酸溶液,再加入饱和硫酸铵溶液,经过_______、_______、_______、_______等一系列操作后所得。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com