
| A�� | CH3OH��ȼ����Ϊ192.9kJ•mol-1 | |
| B�� | 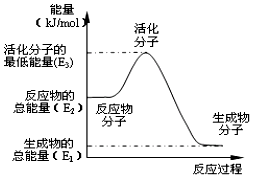 ��Ӧ���е������仯��ͼ��ʾ���ҡ�H1=E2-E1 | |
| C�� | 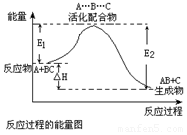 ��Ӧ���е������仯��ͼ��ʾ���ҡ�H2=E2-E1 | |
| D�� | ���ݢ���֪��ӦCH3OH��l��+$\frac{1}{2}$O2��g���TCO2��g��+2H2��g����H��-192.9kJ•mol-1 |
���� A��ȼ������Ӧ����Һ̬ˮ���ɢڿ�֪����������
B����Ϊ���ȷ�Ӧ����ͼ��Ϊ���ȷ�Ӧ��
C����Ӧ��Ϊ���淴Ӧ�Ļ��֮�
D���ɢڿ�֪��Һ̬�״�ת��Ϊ��̬�����������Ң�Ϊ���ȷ�Ӧ���ʱ�Ϊ����
��� �⣺A��ȼ������Ӧ����Һ̬ˮ���ɢڿ�֪������������CH3OH��ȼ���ȴ���192.9kJ•mol-1����A����
B����Ϊ���ȷ�Ӧ����ͼ��Ϊ���ȷ�Ӧ�����߲�������B����
C����Ӧ��Ϊ���淴Ӧ�Ļ��֮����H2=E1-E2����C����
D���ɢڿ�֪��Һ̬�״�ת��Ϊ��̬�����������Ң�Ϊ���ȷ�Ӧ���ʱ�Ϊ��������ݢ���֪��ӦCH3OH��l��+$\frac{1}{2}$O2��g���TCO2��g��+2H2��g����H��-192.9kJ•mol-1����D��ȷ��
��ѡD��
���� ���⿼�鷴Ӧ�����ʱ䣬Ϊ��Ƶ���㣬����ͼ�������仯��ȼ�����жϡ��ʱ����ܹ�ϵ��Ϊ���ؼ������ط�����Ӧ�������Ŀ��飬ע��ѡ��DΪ�״��㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������Һϡ��100����ϡ�ͺ���ҺpH��С˳�ۣ��ܣ��ڣ��� | |
| B�� | ������Ģۺֱܷ͢��õ�Ũ�ȵ�������Һ�кͣ�����������Һ��������ۣ��� | |
| C�� | ������Ģں͢ۻ������ǿ�������Σ���Ϻ���Һ������ | |
| D�� | ������Ģٺ͢ڷֱ���������п����Ӧ���ɵ�������ͬ��ͬѹ��������٣��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ƽ���г�����һ���ȷ��0.01g | |
| B�� | ����ƿ�ϱ����¶Ⱥ�������ʹ��ǰҪ����Ƿ�©ˮ | |
| C�� | ����������Һʱ����������Ͳ�м���һ�������ˮ��������עŨ���� | |
| D�� | �����Ȼ�̼�����ͻ�ƾ����л��ܼ������Դӵ�ˮ����ȡ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
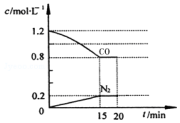 �ش��������⣺
�ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ����ʵ | �� �� | |
| �� | SO2ʹ���Ը��������Һ��ɫ | ��֤SO2��Ư���� |
| �� | ��ĥ�ڲ���ƿ����NaOH��Һ�����ȵĴ�����Һ�[ϴ�����︽�е����� | ��������������ԭ��Ӧ |
| �� | ȡ����Na2SO3��Ʒ����Ba��NO3��2��Һ������ɫ�������μ�ϡ���ᣬ�������ܽ� | ֤��Na2SO3���������� |
| �� | ij��Һ����ϡ���������ʹ����ʯ��ˮ����ǵ���ɫ��ζ���壬����Һ�μ�CaCl2��Һ���а�ɫ����'���� | ȷ������Һ����CO32- |
| �� | ij��ɫ��Һ�м���Ũ����������Һ�����ȣ�����������ʹʪ���ɫʯ����ֽ���� | ����Һһ����NH4+ |
| A�� | �٢� | B�� | �ۢܢ� | C�� | �ڢ� | D�� | �ܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ڽ���Ԫ����ǽ���Ԫ�صķֽ��߸�������Ѱ���Ʊ��뵼����ϵ�Ԫ�� | |
| B�� | �ڹ���Ԫ���п���Ѱ���Ʊ����������º���ʴ��Ԫ�� | |
| C�� | �ڵ�����Ԫ�صķֲ���������Ԫ�����ڱ��е�λ�������й�ϵ | |
| D�� | �ڽ���Ԫ���������Ѱ���Ʊ�����ũҩ���ϵ�Ԫ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com