
A.碳、硅 B.硅、硫? C.碳、硫 D.氧、氮?
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
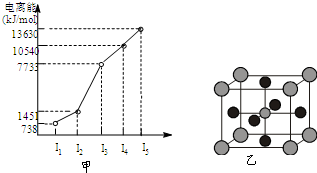 有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.
有X、Y、Z、W四种元素,原子序数依次减小.已知X是第四周期的主族元素,其部分电离能如图甲所示;X、Y元素具有相同的最高正化合价;Z 原子p轨道共有3个电子;W原子价电子排布式为nsnnpn.查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速变暗。
(1)D的原子结构示意图为 ;
(2)元素E在元素周期表中位于第 族;
(3)C、D、E离子半径的大小关系为 (用离子符号表示);
(4)元素B的单质与元素C的单质加热时生成化合物甲,化合物甲中所含化学键为
试写出甲与水反应的离子方程式 ;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙和丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则x y(填写“>”、“<”或“=” )
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,反应的产物不污染环境,其化学方程式为 (不需要配平)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省高三上学期“一诊”模拟理综化学试卷(解析版) 题型:填空题
A、B、C、D、E、F是周期表中的前20号元素,原子序数逐渐增大。A元素是宇宙中含量最丰富的元素,其原子的原子核内可能没有中子。B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相等;C元素原子最外层p能级比s能级多1个电子;D原子p轨道上成对电子数等于未成对电子数;E的常见化合价为+3;F最高正价与最低负价的代数和为4; G+的M层电子全充满。用化学式或化学符号回答下列问题:

(1)G的基态原子的外围电子排布式为 ,周期表中F属于 区。
(2)B与F形成的一种非极性分子的电子式为 ;F的一种具有强还原性的氧化物分子的VSEPR模型为
(3)BD2在高温高压下所形成的晶胞如右图所示。该晶体的类型属于_______
(选填“分子”、“原子”、“离子”或“金属”)晶体
(4)设C元素的气态氢化物为甲,最高价氧化物的水化物为乙,甲与乙反应的产物为丙。常温下,有以下3种溶液:①pH=11的甲的水溶液 ②pH=3的乙的水溶液 ③pH=3的丙溶液,3种溶液中水电离出的cH+之比为
(5)丁、戊分别是E、F两种元素最高价含氧酸的钠盐,丁、戊溶液能发生反应。当丁、戊溶液以物质的量之比为1:4混合后,溶液中各离子浓度大小顺序为
(6)A和C形成的某种氯化物CA2Cl可作杀菌剂,其原理为CA2Cl遇水反应生成一种具有强氧化性的含氧酸,写出CA2Cl与水反应的化学方程式:___________________________
(7)往G的硫酸盐溶液中加入过量氨水,可生成一种配合物X,下列说法正确的是___ __
A.X中所含化学键有离子键、极性键和配位键
B.X中G2+给出孤对电子,NH3提供空轨道
C.组成X的元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省潍坊市高三12月阶段测试化学试卷 题型:填空题
A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质。

(1)D的原子结构示意图为 ;
(2)元素E在元素周期表中位于第 族;
(3)C、D、E离子半径的大小关系为 (用离子符号表示);
(4)元素B的单质与元素C的单质可发生化学反应生成化合物甲,则甲的化学式为
,实验证明甲能够与水发生化学反应,试写出甲与水反应的离子方程式
;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则x y(填写“>”、“<”或“=”=;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为 (不需要配平)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com