
海水是巨大的资源宝库。下图是人类从海水资源获取某些重要化工原料的流程示意图。


回答下列问题:
(1)操作A是_________________(填实验基本操作名称)。用何种方法知道海水晒盐的过程中溶液里食盐含量在逐渐提高?________
a.分析氯化钠含量 b.测定溶液密度 c.观察是否有沉淀析出
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)向苦卤中通入Cl2,发生反应的离子方程式是____________________________,操作C是_______________________________。
(4)上图中虚线框内流程的主要作用是_______________________;与之目的相同的流程在上图中还有几处,试指出其中一处________________________。
(5)将MgCl2转化为Mg时获得的副产品是_____________,用化学方程式表示该物质的某种用途______________________________________。
(1)蒸发结晶(1分),b(2分)
(2)c;(1分)
(3)Cl2 + 2Br- → Br2 + 2Cl-;(2分) 热空气吹出(1分)
(4)富集Br2(1分);海水蒸发结晶得到粗盐、苦卤→Mg(OH)2→MgCl2溶液。(写出其中之一即可,1分)
(5)Cl2;(1分) Cl2 + 2NaOH → NaCl + NaClO + H2O(其他合理答案均可)(2分)
【解析】
试题分析:
(1)从海水中得到粗盐的操作应该是蒸发结晶。氯化钠的含量测定比较复杂,而观察法又不准确,所以最好的办法是测定溶液的密度,答案选b。
(2)向苦卤中加入石灰乳即可生成氢氧化镁沉淀,答案选c。
(3)冷却具有氧化性,能把溴离子氧化生成单质溴,反应的方程式是Cl2 + 2Br- → Br2 + 2Cl-;要使生成的单质溴溢出,则通过热空气吹出即可。
(4)上图中虚线框内流程的主要作用是富集单质溴。根据流程图可判断海水蒸发结晶得到粗盐、苦卤→Mg(OH)2→MgCl2溶液等均是富集单质溴的。
(5)电解熔融的氯化镁可以冶炼金属镁,同时得到氯气。在工业上氯气可以制备漂白液,反应的方程式是Cl2 + 2NaOH → NaCl + NaClO + H2O。
考点:海水资源的综合利用、化学实验基本操作、元素及化合物知识。


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
| ||
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
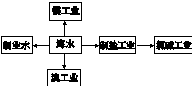
| A、海水制淡水主要有蒸馏法、电渗析法、离子交换法等 | B、海水制盐、发展氯碱工业都是发生物理变化 | C、海水提溴过程中先通入Cl2将溴离子氧化为溴单质 | D、工业上用电解熔融MgCl2的方法制取金属镁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com