
| c(H+) |
| c(OH-) |
| A、该溶液中由水电离出的c(H+)=l×10-13mol/L |
| B、由pH=4的HA与pH=10的NaOH溶液等体积混合,溶液中c(Na+)>c(A-)>c(OH-)>c(H+) |
| C、浓度均为0.1mol/L的HA和NaA溶液等体积混合,若溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) |
| D、0.1mol?L-1 HA溶液与0.05mol?L-1 NaOH溶液等体积混合后所得溶液中c(H+)+c(Na+)=c(OH-)+c(A-) |
| c(H+) |
| c(OH-) |
| c(H+) |
| c(OH-) |


科目:高中化学 来源: 题型:
| A、在含Al3+总数为NA的AlCl3溶液中,Cl-总数大于3NA |
| B、2L 0.1mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6NA |
| C、常温下,1mol SiC中含有Si-C键的数目为2NA |
| D、标准状况下,2.24L Cl2溶于水,转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
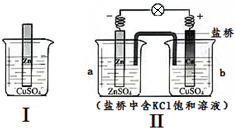
| A、Ⅰ、Ⅱ的反应原理均是Zn+Cu2+=Zn2++Cu |
| B、Ⅰ、Ⅱ中均有电子转移,均是把化学能转化为电能利用 |
| C、随着反应的进行,Ⅰ、Ⅱ中CuSO4溶液颜色均渐渐变浅 |
| D、取a中溶液,加足量Ba(NO3)2溶液,过滤后向滤液中加AgNO3溶液,有沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合 |
| B、向40mL 0.2mol/L的NaOH溶液中通入67.2mLCO2(标况) |
| C、在100mL1mol/LNH4Cl溶液中,投入3.9克Na2O2 |
| D、在20mL0.01mol/LMg(HCO3)2溶液中,投入0.2gMg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |
| A、该电池属于二次电池 |
| B、充电时LiCoO2既发生氧化反应又发生还原反应 |
| C、填充在正负极之间的电解质,除了保持稳定,还需要具有良好导电性,减小电池内阻 |
| D、放电过程中Li+向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量[Al(OH)4]-的溶液中:Na+、OH-、Cl-、CO32- | ||
B、常温下
| ||
| C、能使pH试纸显红色的溶液中:Na+、ClO-、Fe2+、SO42- | ||
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com