
如图是金属镁和卤素单质(X2)反应的能量变化示意图。下列说法正确的是
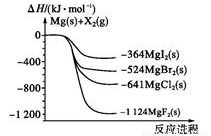
A.由MgCl2制取Mg是放热过程
B.热稳定性:MgI2<MgBr2<MgCl2<MgF2
C.常温下氧化性:F2<Cl2<Br2<I2
D.由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:
MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(g),ΔH=-117kJ·mol-1
科目:高中化学 来源:2016-2017学年江西省高一上第一次月考化学卷(解析版) 题型:推断题
现有三种可溶物质A、B、C,其中A、B是盐,一种是酸式盐,一种是正盐,C是碱,它们溶于水后电离产生的所用离子如下表所示:
阳离子 |
|
阴离子 |
|
请根据下列叙述回答问题:
(1)C的化学式为_________________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______________________, 该反应的离子方程式为___________________.
该反应的离子方程式为___________________.
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸.
①B的化学式为____________,鉴别溶液中B的阴离子的方法是____________________.
②D溶于稀硝酸的离子方程式为________________________.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽省高一上第一次月考化学卷(解析版) 题型:选择题
某同学在实验报告中记录下列数据或操作,其中正确的是
A.用100mL量筒量取8.6mL浓硫酸 B.用托盘天平称量8.75g食盐
C.用500mL的容量瓶来配制需要的450mL溶液 D.用胶头滴管取5mL的某溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江大庆一中高一上10月月考化学试卷(解析版) 题型:选择题
为了配制100mL1mol/L的NaOH溶液,其中有下列几个操作,错误的是( )
①NaOH用称量纸盛装进行称量;
②选刚用蒸馏水洗净的100mL容量瓶进行配制;
③NaOH在烧杯里刚完全溶解时,立即将溶液转移到容量瓶;
④用蒸馏水洗涤烧杯内壁两次,洗涤液都移入容量瓶;
⑤使蒸馏水沿着玻璃棒注入容量瓶,直到溶液的凹液面恰好跟刻度线相切.
A.①③ B.①③⑤ C.②③⑤ D.①②
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:实验题
硫化钠主要用于皮革、毛纺、高档纸张、染料等行业。生产硫化钠大多采用无水芒硝(Na2SO4)—炭粉还原法,其流程示意图如下:
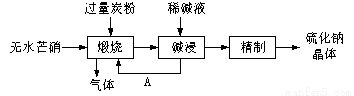
(1)上述流程中“碱浸”后,物质A必须经过 (填写操作名称)处理后,方可“煅烧”;若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生的总的化学反应方程式为 。
(2)上述流程中采用稀碱液比用热水更好,理由是稀碱液能 Na2S水解(选促进或抑制)
(3)取硫化钠晶体(含少量NaOH)加入到硫酸铜溶液中,充分搅拌。若反应后测得溶液的pH=4,则此时溶液中c( S2-)= mol·L-1。(已知:常温时CuS、Cu(OH)2的Ksp分别为8.8×10-36、2.2×10-20)
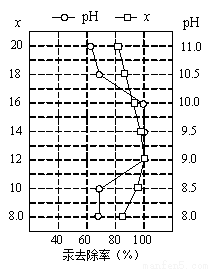
(4)①皮革工业废水中的汞常用硫化钠除去,汞的去除率与溶液的pH和x(x代表硫化钠的实际用量与理论用量的比值)有关(如右图所示)。为使除汞效果最佳,应控制的条件是x控制 、pH控制 。
②某毛纺厂废水中含0.001 mol·L-1的硫化钠,与纸张漂白后的废水(含0.002 mol·L-1 NaClO)按1:2的体积比混合,能同时较好处理两种废水,处理后的废水中所含的主要阴离子有 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列图示与对应的叙述相符的是
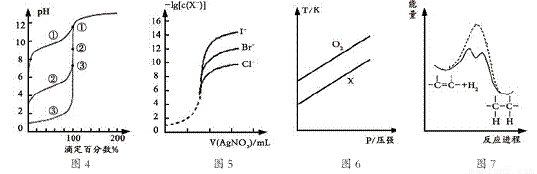
A. 用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图4曲线确定①的酸性最强
B. 用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图5曲线,可确定首先沉淀的是Cl-
C. 在体积相同的两个密闭容器中,分别充入相同质量O2和X气体,由图6可确定X可能是CH4气体
D. 由图7可说明烯烃与H2加成反应是放热反应,虚线表示在有催化剂的条件下进行
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上第一次测试化学试卷(解析版) 题型:选择题
下列叙述正确的是
A.用乙醇或CCl4均可萃取碘水中的碘单质
B.CO2和SiO2晶体熔化时,克服粒子间作用力的类型相同
C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构
D.24Mg34S晶体中电子总数与中子总数之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
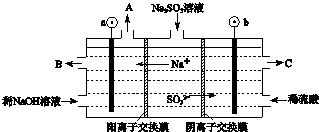
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com