
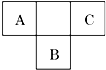
 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B的最外层电子数是其电子层数两倍. .
. .
.分析 根据A、C两元素的原子核外电子数之和等于B原子的质子数,原子核外电子数等于核内的质子数,设B的原子序数为x,则A的原子序数为x-9,y的原子序数为x-7,则有x-9+x-7=x,x=16,则B为S元素,符合:B的最外层电子数是其电子层数两倍,则A为N元素,C为F元素,根据元素所在周期表中的位置结合元素周期律知识解答该题.
解答 解:依据分析可知:A为氮,B为硫,C为氟,
(1)A为N,氮气为双原子分子,氮气的电子式为 ,故答案为:
,故答案为: ;
;
(2)B为S元素,原子序数为16,原子核外有3个电子层,最外层电子数为6,则位于周期表第三周期ⅥA族,
故答案为:第三周期第ⅥA族;
(3)C为F,原子核外有9个电子,最外层电子数为7,核内有9个质子,结构示意图为 ,
,
故答案为: ;
;
(4)S的原子半径大于O的原子半径,O原子半径大于F原子半径,故S>F,A的气态氢化物为NH3,B的最高价氧化物对应水化物为H2SO4,反应的化学方程式为2NH3+H2SO4=(NH4)2SO4,故答案为:>;2NH3+H2SO4=(NH4)2SO4.
点评 本题主要考查元素的位置结构性质的相互关系及应用,注意根据元素所在周期表中的位置和质子数的关系推断元素的种类,把握元素周期律的相似性和递变性的规律.


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 铅笔芯的原料是重金属铅,儿童在使用时不可以用嘴吮吸铅笔,以免引起铅中毒 | |
| B. | CO有毒,生有煤炉的居室放置数盆清水,这样可有效的吸收CO,防止煤气中毒 | |
| C. | 汽水浇灌农田有一定的道理,其中二氧化碳的缓释,有利于作物的光合作用 | |
| D. | 纯碱又名烧碱,成分是氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为棕黄色 | Fe2+具有还原性 | |
| ② | 在FeCl2溶液中加入锌片 | Zn+Fe2+=Zn2++Fe | ||
| ③ | 在FeCl3溶液中加入足量铁粉 | Fe3+具有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀释浓硫酸先在量筒中加一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸 | |
| B. | 过滤时,漏斗里的滤液应低于滤纸的边缘 | |
| C. | 燃着的钠应立即用水灭火 | |
| D. | 测定溶液的pH值时,应用湿润玻棒蘸取待测液,直接滴在干燥的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
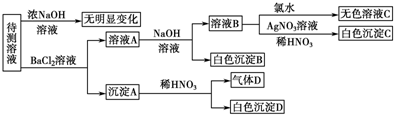
| 肯定存在的离子 | 肯定没有的离子 | |
| 化学式或离子符号 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、NO2、N2、粉尘 | B. | CO2、Cl2、N2、雾 | C. | SO2、NO2、CO、烟尘 | D. | CO2、NO、NH3、H2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A2B3 | B. | BA2 | C. | AB4 | D. | B3A2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com