
| �¶�/�� | 400 | 500 | 830 | 1 000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n��CO2��/mol | 3 | 2.4 | 3.2 | 1 |
| n��H2��/mol | 2 | 1.5 | 2.5 | 1 |
| n��CO��/mol | 1 | 2 | 3.5 | 0.5 |
| n��H2O��/mol | 5 | 2 | 2 | 2 |
���� ��1������ƽ�ⳣ�����¶ȵı仯���ƽ���ƶ�ԭ�������жϷ�Ӧ�������仯�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ���ѹǿ����
��3������830��ʱ��ƽ�ⳣ��k=1������Ũ�ȼ����ƽ�ⳣ���Ƚ��жϣ�
��4��830��ʱ��ƽ�ⳣ��k=1������ƽ������ʽ��ʽ����ƽ��ʱ�����ʵ����ʵ����������������������������
��� �⣺��1�����ݱ������ݿ�֪���¶�����ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ���������Ӧ���ȣ��ʴ�Ϊ�����ȣ�
��2���¶����ߣ���Ӧ��������ƽ�����淴Ӧ�����ƶ�����Ӧǰ������������䣬����������ѹǿ֮�ȵ����¶�֮�ȣ�����ѹǿ���ʴ�Ϊ����������
��3������830��ʱ��ƽ�ⳣ��k=1���㣻
A��Q=$\frac{2��3}{5��1}$��1����Ӧ���淴Ӧ�����ƶ�����A��ȷ��
B��Q=$\frac{2.4��1.5}{2��2}$=0.9��1����Ӧ������Ӧ�����ƶ�����B����
C��Q=$\frac{3.2��2.5}{3.5��2}$=1.14��1����Ӧ���淴Ӧ�����ƶ�����C��ȷ��
D��Q=$\frac{1��1}{0.5��2}$=1���ﵽƽ��״̬��ƽ�ⲻ�ƶ�����D����
�ʴ�Ϊ��AC��
��4��830��ʱ����2L���ܱ������м���4molCO��g����6molH2O��g���ﵽƽ��ʱ����һ����̼ת�����ʵ���Ϊx������ƽ������ʽ��ʽ�õ�
CO��g��+H2O��g��?H2��g��+CO2��g��
��ʼ����mol�� 4 6 0 0
�仯����mol�� x x x x
ƽ������mol�� 4-x 6-x x x
ƽ�ⳣ��JK=1���������ʵ������㣬��K=$\frac{{x}^{2}}{��4-x����6-x��}$=1
x=2.4mol
�������������Ϊ$\frac{2.4}{4+6}$��100%=24%
�ʴ�Ϊ��24%��
���� �����ۺϿ��黯ѧƽ��ļ��㣬Ϊ��Ƶ���㣬������ѧ���ķ��������������Ŀ��飬����ע����ջ�ѧƽ�ⳣ����������Ӧ�ã��ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
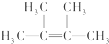 ��������2��3-����-2-��ϩ��
��������2��3-����-2-��ϩ�� ��
�� ����CH3CH2��2C=CH2������˳���칹����
����CH3CH2��2C=CH2������˳���칹�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�48g O2�к���ԭ����Ϊ3NA | |
| B�� | ��״���£�22.4 L H2O������ԭ����Ϊ3NA | |
| C�� | 1 mol/L��K2SO4��Һ�У���2 NA��K+ | |
| D�� | 24g Mg��ΪMg2+ʱʧȥ�ĵ�����ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | A��B����Է�������֮��Ϊa��b | |
| B�� | ͬ��ͬѹ�£�A��B��ԭ����֮��Ϊb��a | |
| C�� | ͬ������A��B�����ʵ���֮��Ϊb��a | |
| D�� | ͬ��ͬѹ�£�ͬ�����A��B������֮��Ϊa��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H| �¶� | 250�� | 300�� | 350�� |
| K | 3.041 | 1.000 | 0.120 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���֮��11��8 | B�� | �ܶ�֮�� 11��8 | ||
| C�� | ���ʵ���֮��8��11 | D�� | ԭ����֮��8��11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ö����ЧӦ�������ֵ����ܽ��ͷ���ˮ | |
| B�� | 1L1 mol•L-1Fe��OH��3�����У�������ĿС��NA | |
| C�� | PM2.5��ָ������ֱ���ӽ���2.5��10-6m��1m=109nm���Ŀ����Ҳ�ƿ�����������Щϸ�������ɢ�ڿ������γɵķ�ɢϵ�ǽ��� | |
| D�� | Fe��OH��3����ĵ�Ӿʵ��˵���˽�����е�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com