
【题目】下表列出了①~⑦七种元素在周期表中的位置。
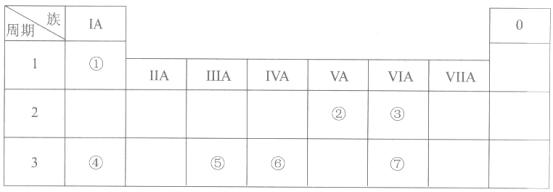
请按要求回答:
(1)七种元素中,原子半径最大的是(填元素符号)_________。
(2)③与⑦的气态氢化物中,稳定性较强的是(填化学式)_________。
(3)元素⑥的最高价氧化物对应的水化物是(填化学式)_________。
(4)由①、②、③三种元素组成的离子化合物是_________,检验该化合物中阳离子的方法是_________。
(5)含有上述元素的物质间存在以下转化。
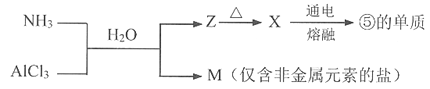
M所含的化学键类型是_________。X生成⑤的单质的化学方程式是_________。
【答案】NaH2OH2SiO3NH4NO3取少量该化合物于试管中,加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明有铵离子存在。离子键和极性共价键2Al2O3(熔融)![]() 4Al+3O2↑
4Al+3O2↑
【解析】
根据元素周期表知,①是H元素、②是N元素、③是O元素、④是Na元素、⑤是Al元素、⑥是Si元素、⑦是S元素,利用元素、单质、化合物的性质及元素周期律来分析解答。
根据元素周期表知,①是H元素、②是N元素、③是O元素、④是Na元素、⑤是Al元素、⑥是Si元素、⑦是S元素。(1)同周期从左到右,原子半径依次减小,同主族从上到下,原子半径依次增大,故这七种元素中,原子半径最大的是Na;(3)同主族从上到下,非金属性减弱,气态氢化物的稳定性减弱,故③与⑦的气态氢化物中,稳定性最强的是H2O;(3)元素⑥为硅元素,其最高价氧化物对应的水化物是H2SiO3;(4)由①、②、③三种元素组成的离子化合物是NH4NO3,检验该化合物中阳离子铵根离子的方法是取少量该化合物于试管中,加入NaOH浓溶液,加热,将湿润的红色石蕊试纸放在试管口,若试纸变蓝,则证明有铵离子存在;(5)氯化铝溶液中通入氨气反应生成氢氧化铝和氯化铵,根据M为仅含非金属元素的盐可知M为氯化铵,氯化铵由铵根离子和氯离子构成,铵根离子中氮原子与氢原子形成共价键,故M所含的化学键类型是离子键和极性共价键;Z为氢氧化铝,加热氢氧化铝生成氧化铝和水,则X为氧化铝,电解熔融氧化铝得到⑤的单质铝,反应的化学方程式为2Al2O3(熔融)![]() 4Al+3O2↑。
4Al+3O2↑。


科目:高中化学 来源: 题型:
【题目】将二氧化硫通入显红色的酚酞试液中,发现红色消失,主要原因是( )
A.二氧化硫具有漂白性B.二氧化硫具有还原性
C.二氧化硫具有氧化性D.二氧化硫溶于水后生成酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组对某废旧合金(含有Cu、Fe、Si三种成分)进行分离、回收。其工业流程如下:
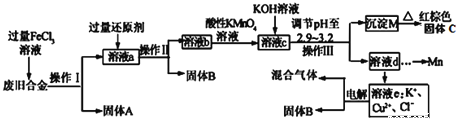
已知:298K时,Ksp[Cu(OH)2]=2.0×10-20,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=1.9×10-13,
根据上面流程回答有关问题:
(1)操作Ⅰ、Ⅱ、Ⅲ一定都不含有的操作是________。
A.过滤B.洗涤C.干燥D.蒸馏
(2)过量的还原剂应是__________________,溶液a中发生的反应的离子方程式为________________________________。
(3)若用xmol/LKMnO4溶液处理溶液b,当恰好将溶液中的阳离子完全氧化时消耗KMnO4溶液ymL,则最后所得红棕色固体C的质量为________g(用含x、y的代数式表示)。
(4)将溶液c调节pH至2.9-3.2的目的是______________________________。
(5)常温下,取0.2mol/L的CuCl2溶液,若要使Cu2+开始沉淀,应调节pH至___________。
(6)用惰性电极电解溶液e制取固体B,所发生的化学反应方程式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.P4和NO2都是共价化合物
B.CCl4和NH3都是以极性键结合的极性分子
C.H2O2的分子是含有极性键的非极性分子
D.在SiC和SiO2晶体中,都不存在单个小分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取两份铝片,第一份与足量稀硫酸反应,第二份与足量NaOH溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为 ( )
A.2:3B.1:1C.3:2D.1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
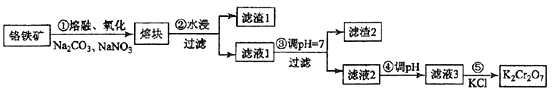
已知:铬元素在酸性条件下以重铬酸根离子的形式存在。回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
Na2CrO4+Fe2O3+CO2+ NaNO2,上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是_____________________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________________(填“大”或“小”),原因是________________(用离子方程式表示)。
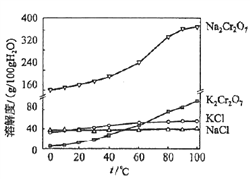
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________ (填标号)得到的K2Cr2O7固体产品最多。
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1kg铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品m2kg,产率为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是来自石油的重要有机化工原料。结合以下路线回答:
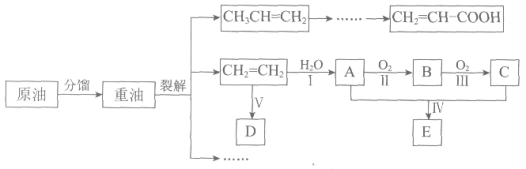
已知:2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(1)D是高分子,用来制造包装材料,其结构简式是________。
(2)反应II的化学方程式是________。
(3)E有香味,实验室用A和C反应制取E的装置如图所示。
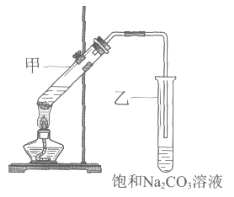
①反应IV的化学方程式是________,其反应类型是________。
②分离出试管乙中油状液体需要用到的仪器是________(填序号)。
a. 漏斗 b. 分液漏斗 c. 长颈漏斗
③实验结束,振荡试管乙,有无色气泡产生,其主要原因是________(用化学方程式表示)。
(4)产物CH2=CH-COOH可能发生的反应有________(填序号)。
a. 加成反应 b. 取代反应 c. 氧化反应 d. 中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能给合质子的分子或离子都是碱,按照这种理论下列物质既属于酸又属于碱的是 ( )
A. NaOH B. HCl C. NaH2PO4 D. Fe2O3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com