
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����( )
A.ͼ�ױ�ʾ2SO2(g)+O2(g)2SO3(s)��H��0��t1ʱ�ı��������������ϵ��ѹǿ
B.ͼ��NaCl��ҺŨ�ȹ�������ʴ���ʽ��ͣ�˵��NaClŨ��Խ����Һ��O2��Ũ��ԽС
C.ͼ��˵��ʯīת��Ϊ���ʯ�ķ�Ӧ�ġ�H��0
D.ͼ����һ�������·�����Ӧ��4NH3+4NO+O24N2+6H2O���˹��̡�H��0
���𰸡�A
��������
A. ����ͼ��t1ʱ��v��˲�䲻�䣬v��˲��������������Ӧ��Ũ�ȣ���A����
B. O2�ĺ���Ӱ��̼����NaCl��Һ�еĸ�ʴ���ʣ�����ͼ��ʴ�������������������С��˵����NaClŨ�Ƚϸ�ʱ��Һ��O2��Ũ�ȼ��٣�������Ӧ�������¸�ʴ���ʽ��ͣ���B��ȷ��
C. ʯī�������ڽ��ʯ����������ʯīת��Ϊ���ʯ�ķ�Ӧ����H��0����C��ȷ��
D. ͼ����һ�������·�����Ӧ��4NH3+4NO+O24N2+6H2O������ͼ�����ȹ���ƽ��ֵ��Ϊԭ����T1��T2�������¶ȣ�NO�����Ũ������ƽ�������ƶ���������ӦΪ���ȷ�Ӧ����H��0����D��ȷ��
��ѡA��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������CH3COOH��NH3��H2O�ĵ��볣����ȣ����ڳ�������10mL0.0lmol��L-1�İ�ˮ�еμ���ͬŨ�ȵĴ�����Һ���ڵμӹ�������Һ��pH�����Ӵ�����Һ�������ϵ��ͼ��ʾ������˵���������

A.X���ʾCH3COOH��NH3��H2Oǡ����ȫ��Ӧ����n=7
B.���Ŵ�����Һ���룬ˮ�ĵ���̶���������С��Ȼ������������
C.�����´���ĵ��볣��ԼΪ10-48
D.Y����Һ��c(NH3H2O)+c(OH-)=c(CH3COO-)+2c(CH3COOH)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�������ع�ʽ����:
(1)16gO3��16g O2������֮��Ϊ________������ԭ����֮��Ϊ________��
(2)12.7g FeCl2��������ˮ���500mL��Һ����Ũ��Ϊ________molL-1���Ӹ���Һ��ȡ��100mL��Һ������C1-��Ũ��Ϊ________molL-1��
(3)ij�����Ȼ���MCl227g������0.40 mol Cl-������Ȼ�������ʵ���Ϊ________��M��Ħ������Ϊ________��
(4)���������ĸ���������ԭ�������ɴ�С��˳�����е���____________��
��34g���� �ڱ�״����44.8L���� ��25��Cʱ18 mLˮ ��0.5 mol H2SO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£������Ϊ3 L���ܱ������У�һ����̼��������Ӧ���ɼ״�������ΪCu2O/ZnO����CO(g)��2H2(g)![]() CH3OH(g)��
CH3OH(g)��

��������������и��⣺
��1����Ӧ�ﵽƽ��ʱ��ƽ�ⳣ������ʽK��_______________�������¶ȣ�Kֵ_______������������������С����������������
��2����500�����ӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��_____________��
��3���������������������£��Դ���E�����ϵ���ѹ����ԭ����1/2�������йظ���ϵ��˵����ȷ����_______��
a��������Ũ�ȼ��� b������Ӧ���ʼӿ죬�淴Ӧ����Ҳ�ӿ�
c���״������ʵ������� d������ƽ��ʱn(H2)/n(CH3OH)����
��4�����о�����Ӧ������������õ�ΪCu2O����Ӧ��ϵ�к�����CO2������ά�ִ���Cu2O�������䣬ԭ���ǣ�_______________________���û�ѧ����ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������þͭ�Ͻ���뵽ϡ�����У�����ǡ����ȫ��Ӧ�����跴Ӧ�����л�ԭ����ȫ��NO����������Һ�м������ʵ���Ũ��Ϊ3 mol��L��1 NaOH��Һ��������ȫ��������ɳ�����������ԭ�Ͻ����������5.1 g���������й���������ȷ���ǣ� ��
A. ����Ͻ������������Ϊ6.4 g
B. �μӷ�Ӧ����������ʵ���Ϊ0.1 mol
C. ������ȫʱ����NaOH��Һ�����Ϊ150 mL
D. �ܽ�Ͻ�ʱ�ռ���NO���������ڱ�״����Ϊ2.24 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾ��Ӧ��ѧ��Ӧ�����ӷ���ʽ��ȷ����()
A.NH4HCO3��Һ�����KOHŨ��Һ���ȣ�![]() + OH-
+ OH-![]() NH3��+ H2O
NH3��+ H2O
B.��Ba(OH)2��Һ�еμ�NaHSO4��Һ��ǡ��Ϊ���ԣ� Ba2++ OH- + H+ +![]() = BaS04��+ H2O
= BaS04��+ H2O
C.����Ǧ��Һͨ����������ķ�Ӧ��Pb(CH3COO)2 + H2S = PbS + 2CH3COOH
D.��NaAlO2��Һ��ͨ�����CO2��2![]() + CO2 + 3H2O = 2Al(OH)3��+
+ CO2 + 3H2O = 2Al(OH)3��+ ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������c���Ʊ�ԭ�����£�
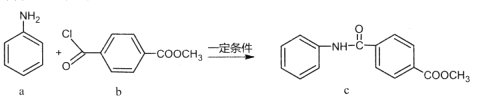
����˵����ȷ����
A.�÷�ӦΪ�ӳɷ�ӦB.������a������ԭ��һ����ƽ��
C.������C��һ�ȴ�������Ϊ5��D.������b��c������NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH=1��ϡ�����������롪������BaCl2����Һ�У�ǡ��ʹBa2+������ȫ����ʱ��Һ�����Ϊ100 mL(���ʱ��Һ����ı仯���Բ���)���һ����Һ��pH=2����ԭBaCl2��Һ��Cl-��Ũ��ԼΪ�� ��
A. 0.011 mol/L B. 0.22 mol/L C. 0.022 mol/L D. 0.11 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ����Ƽ����Ӧ�����ӷ���ʽ����ȷ����
A.��������ˮ�Ʊ������Cl2��H2O![]() 2H+��Cl����ClO��
2H+��Cl����ClO��
B.��Ũ�����ữ��KMnO4��Һ��H2O2��Ӧ��֤��H2O2���л�ԭ�ԣ�5 H2O2��2MnO4����6H+ === 5O2����2Mn2+��8H2O
C.�����ʯ��ˮ�м���������NaHCO3��Һ����������Ca2+��OH����HCO3��=== CaCO3����H2O
D.��ͭ���缫���NaCl��Һ�Ʊ�������2Cl����2H2O![]() H2����Cl2����2OH��
H2����Cl2����2OH��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com