
����Ŀ��ij��ҵ�����к���CO��CO2��N2��SO2�����壬��Na2SO3��Һ���ղ�����SO2�Ĺ�������ͼ��ʾ��
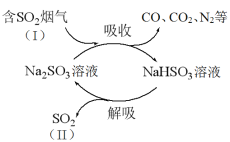
��1��SO2��Ũ�ȣ�I________II���������������
��2������������п���ѭ��ʹ�õ�������________��
��3���������չ�������Ҫ��Ӧ�Ļ�ѧ����ʽ��________��
��4������������Ҫ���ȣ�����������г���������SO42-������
�� ֤�������к�SO42-��ʵ�鷽���ǣ�ȡ���������������Һ��________�������������
�� ����SO42-��ԭ����_______��
���𰸡��� Na2SO3 Na2SO3 + SO2 + H2O = 2NaHSO3 �ȼ���������ᣬ�ټ���BaCl2��Һ���а�ɫ�������� ���ȹ����У�SO32-����HSO3-���������е�����������SO42-����2SO32- + O2 = 2SO42- ��
��������
�����к���CO��CO2��N2��SO2�����壬ͨ�������������ն�������Ӧ����ʽΪNa2SO3 + SO2 + H2O = 2NaHSO3����˸����˶����������������������ֽ⣬���ɶ�������ˮ���������ƣ���Ӧ����ʽΪ2NaHSO3 = Na2SO3 + SO2 + H2O���������������������е���Ϊ+4�ۣ��ױ������е���������Ϊ+6�۵�����������ݴ˽��⡣
(1)�����к���CO��CO2��N2��SO2�����壬ͨ�������������ն���������˸����˶����������������������ֽ⣬���ɶ�������,���SO2��Ũ�ȣ�I��II��
(2) �����к���CO��CO2��N2��SO2�����壬ͨ�������������ն���������˸����˶����������������������ֽ⣬���ɶ�������ˮ���������ƣ���˿���ѭ��ʹ�õ���Na2SO3��
(3) ����������Һ���ն�����������Ӧ�������������ƣ���Ӧ����ʽΪNa2SO3 + SO2 + H2O = 2NaHSO3��
(4) ��������ļ��鷽���ǣ��ȼ���������ᣬ�ټ���BaCl2��Һ���а�ɫ�������ɣ�
���������������������е���Ϊ+4�ۣ��ױ������е���������Ϊ+6�۵������������Ӧ����ʽΪ��2SO32- + O2 = 2SO42-��


 ����ѧ���ʱѧ����ϵ�д�
����ѧ���ʱѧ����ϵ�д� �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������½������ʵ�顣���н�����ȷ����
A����NaHCO3��Һ��ͨCO2��pH=7��c(Na+)=c(HCO3-)+c(CO32-)
B����CH3COONa��Һ�м����Ũ�ȵ���������c(Na+)��c(Cl-)
C����Ũ��Ϊ0.1mol/LNaHSO4��Һ�м����Ũ�ȵ������Ba(OH)2��Һ��pH��13
D����0.1molAgClͶ�뵽100mL0.1mol/LNaCl��Һ�У�c(Ag+)=c(Cl-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����-CO2��صĹ���ԭ����ͼ��ʾ�����յ�CO2ת��ΪNa2CO3�����̼�������ڶ��̼����(MWCNT)�缫���棬����˵������ȷ����(����)
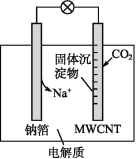
A.������ӦʽΪNa��e-=Na+
B.���̼����(MWCNT)����ص�����
C.�������Ҵ������ĸʴ����������л��ܼ�
D.����ܷ�ӦʽΪ4Na+3CO2=2Na2CO3+C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����²���������ʵĵ��볣�����±���
��ѧʽ | HF | HClO | H2CO3 | NH3��H2O |
���볣�� | Ka��6.8��10��4 | Ka��4.7��10��8 | Ka1��4.2��10��7 Ka2��5.6��10��11 | Kb��1.7��10��5 |
(1)�����£����ʵ���Ũ����ͬ��������Һ����HF��Һ����HClO��Һ����NaHCO3��Һ����NH3��H2O��Һ����pH�ɴ�С��˳����____________(����ĸ)��
(2)25 ��ʱ��pH��4��NH4Cl��Һ��pH��4��HF��Һ����ˮ�������c(H��)֮��Ϊ________��
(3)0.1 mol��L��1NaClO��Һ��0.1 mol��L��1NaHCO3��Һ�У�c(ClO��) ______ c(![]() )(��>��<��)����ʹ����������ҺpH��ȵķ�����________(����ĸ)��
)(��>��<��)����ʹ����������ҺpH��ȵķ�����________(����ĸ)��
A����NaClO��Һ�м�����ˮ
B����NaClO��Һ�м�������NaOH����
C����NaHCO3��Һ�м�����ˮ
D����NaHCO3��Һ�м�����NaOH����
(4)��NaClO��Һ��ͨ������CO2����������Ӧ�����ӷ���ʽΪ��__________________________��
(5)�����£�����NH4Cl��Һ�У�![]() ��ˮ�ⳣ��Kh��_________________��
��ˮ�ⳣ��Kh��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ҹ������ֵ���������������������������ϸ���Ӱ���(NH4)2SO4��NH4NO3���л�������ﳾ���ؽ���ͭ�ȡ�
��1��NԪ��ԭ�Ӻ�������Ƶ���״��___�֣���̬ͭԭ�ӵļ۵����Ų�ʽΪ___��
��2��N��O�е�һ�����ܽ�С��Ԫ����__��SO42-�Ŀռ乹��___��
��3�������к���������ˮ�����ˮ����Ԫ�غ���Ԫ��Ҳ���γɻ�����H2O2��������ԭ�ӵ��ӻ��������Ϊ___��H2O2������CC14����ԭ��Ϊ___��
��4��PM2.5����NO��NO�ܱ�FeSO4��Һ�������������[Fe(NO)(H2O)5]SO4����������������ӵ���λ��Ϊ___��
��5���ⶨ������PM2.5Ũ�ȵķ���֮һ����-�������շ�����-���߷���Դ����85Kr����֪Kr����ľ����ṹ��ͼ��ʾ����NAΪ�����ӵ�������ֵ�������߳�Ϊ540pm����þ������__g/cm3(ֻ��ʽ�����㣬KrĦ������Ϊ84g��mol-1)��
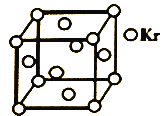
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽ��
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)��H1
2 H2(g)+ O2(g)= 2H2O(g)��H2
C(s)+ O2(g)=CO2(g)��H3
��Ӧ4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)����HΪ
A. 12��H3+5��H2-2��H1 B. 2��H1-5��H2-12��H3
C. 12��H3-5��H2-2��H1 D. ��H1-5��H2-12��H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º�ѹ�ܱ�����M����ͼ�ͺ��º����ܱ�����N����ͼ���У��������о�����a molA��a molB����ʼʱ�����������ΪVL���������·�Ӧ���ﵽ��ѧƽ��״̬��2A��?��+ B��?��![]() xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ����
xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ����

A. x��2
B. ��N��������ܶ���ͼ����ʾ����A��Bֻ��һ������̬
C. AΪ���壬BΪ�����壬��ƽ��ʱM��N��C�����ʵ������
D. ��A��B��Ϊ���壬ƽ��ʱM��A��ת����С��N��A��ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ����Ҫ500mL0.10mol/L��Na2CO3��Һ����ͨ�����²������ƣ�
�ٰѳ����õĹ���Na2CO3����С�ձ��У�����������ˮ�����ܽ⣻
������������ˮϴ���ձ��Ͳ�����2~3�Σ�ÿ��ϴ�ӵ�Һ�嶼С��ת������ƿ��������ҡ�ȣ�
�۸Ǻ�ƿ�����������µߵ���ҡ�ȣ�
�ܰ��ܽ�����������Һ��ȴ�����£�ת������A�У�
�ݼ���������ˮ��Һ���̶���1~2cm�������ý�ͷ�ιܵμ�����ˮ����Һ�İ�Һ����̶������У�
��1�������������ȷ˳��Ϊ__(�����)��
��2��������Na2CO3��������ӦΪ__g��
��3������A��������__��
��4��ȡ��100mL���ƺõ���Һ��������ˮϡ����c(Na2CO3)=0.02mol/L����ϡ�ͺ���Һ�����Ϊ__��
��5�����й�������ƿ��ʹ�÷����У���ȷ����__(����ĸ���)��
A.ʹ��ǰҪ�����Ƿ�©ˮ
B.������ƿ��ֱ���ܽ�����ϡ��Һ��
C.���ձ����ܽ�����Ѹ�ٽ���Һת�Ƶ�����ƿ��
D.������ƿ��ת����Һ�ò���������
E.��ˮʱˮ�������˿̶��ߣ�Ѹ���ý�ͷ�ιܽ�������ˮ����
��6�����в�����ʹ������Һ�����ʵ���Ũ��ƫ�͵���__(����ĸ���)��
A.���ձ��е���Һת�Ƶ�����ƿʱ������������ƿ��
B.���ݶ���ʱ����������ƿ�ϵĿ̶���
C.��ˮ����ʱ��ˮ�������˿̶���
D.ϴ�Ӳ����У�ϴ��Һû��ת������ƿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij����ҩ��̼��ƹ���Ĵ��ȣ���һ�ֳɷ�Ϊ���ۣ�����ȡ12.5g��ҩƬ�����ձ��У����������ϡ���ᣬ��÷�Ӧ�������ձ���ҩƷ����������ʱ��ı仯�������£�
��Ӧʱ��/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
�ձ���ҩƷ������/g | 310.0 | 306.8 | 305.9 | 305.7 | 305.6 | 305.6 | 305.6 |
���㣺(1)���ռ�����״����CO2�����____________________��
(2)����Ʒ��̼��Ƶ���������________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com