
【题目】能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则CH4燃烧的热化学方程式______________________________________________________。
(2)已知:C(s)+O2(g) = CO2(g) △H=-437.3kJ·mol -1
H2(g)+1/2O2(g) = H2O(g) △H=-285.8kJ·mol-1
CO(g)+1/2O2(g) = CO2(g) △H=-283.0kJ·mol-1
则煤气化反应C(s)+H2O(g) = CO(g)+H2(g)的焓变△H=___________ kJ·mol-1。
(3)人们利用原电池原理制作了多种电池,以满足日常生活、生产和科学技术等方面的需要。请根据题中提供的信息,回答下列问题。
①铅蓄电池在放电时的电池反应为Pb+PbO2+2H2SO4==2PbSO4+2H2O,则其正极上的电极反应为________________________________________________________。
②FeCl3溶液腐蚀印刷电路铜板时发生反应:2FeCl3+Cu==2FeCl2+ CuCl2。若将此反应设计成原电池,则负极所用的电极材料为_____;电极反应式:_________________。
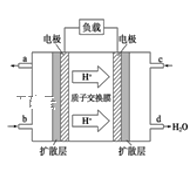
③已知甲醇燃料电池的工作原理如下图所示。该电池工作时,b口通入的物质为_____,该电池正极上的电极反应式为___________________;当6.4g甲醇(CH3OH)完全反应生成CO2时,有___ mol电子发生转移。若将电池的电解质溶液换为KOH溶液,则负极的电极方程式为______________________。
(4)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式为_____________________________________。
【答案】CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol, +131.5 PbO2+4H++SO42-+2e- = PbSO4+2H2O Cu Cu-2e-=Cu2+ CH3OH O2+4H++4e-=2H2O 1.2 CH3OH +8 OH-﹣6e﹣═CO3 2﹣+6 H2O HNO2-2e-+H2O==NO3-+3H+
【解析】
(1)在25℃、101kPa时,8gCH4完全燃烧生成液态水时放出的热量是445.15kJ,则1mol甲烷燃烧放出的热量为:![]() =890.3kJ,则CH4燃烧的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol,
=890.3kJ,则CH4燃烧的热化学方程式是:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol,
故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=890.3kJ/mol;
(2)已知:①C(s)+O2(g)═CO2(g) △H=437.3kJmol1
②H2(g)+![]() O2(g)═H2O(g) △H=285.8kJmol1
O2(g)═H2O(g) △H=285.8kJmol1
③CO(g)+![]() O2(g)═CO2(g) △H=283.0kJmol1
O2(g)═CO2(g) △H=283.0kJmol1
根据盖斯定律:①②③可得:C(s)+H2O(g)═CO(g)+H2(g)△H=437.3kJ/mol (285.8kJ/mol)(283.0 kJ/mol)=+131.5 kJ/mol,
答案为:+131.5;
(3)①放电时PbO2在正极上发生还原反应,所以正极上的电极反应式为PbO2+4H++SO42-+2e- = PbSO4+2H2O。
答案为:PbO2+4H++SO42-+2e- = PbSO4+2H2O;
②反应2FeCl3+Cu=2FeCl2 +CuCl2中,Cu失电子发生氧化反应:Cu-2e-=Cu2+,所以原电池中的负极材料是Cu;
答案为:Cu;Cu-2e-=Cu2+;
③原电池中H+向正极移动,根据图中氢离子的移动方向可知C口一侧的电极为正极,所以b口一侧的电极是负极,甲醇在负极上发生氧化反应,故b 口通入的是CH3OH;正极上氧气发生还原反应,得电子,与氢离子结合生成水,电极反应式为O2+4H++4e-=2H2O;6.4 g甲醇的物质的量为![]() =0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当0.2mol甲醇完全反应生成CO2时,转移电子是1.2mol,负极上的电极反应式为CH3OH +8 OH-﹣6e-═CO32-+6 H2O,
=0.2mol,根据反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g),当消耗甲醇2mol时,转移电子为12mol,所以当0.2mol甲醇完全反应生成CO2时,转移电子是1.2mol,负极上的电极反应式为CH3OH +8 OH-﹣6e-═CO32-+6 H2O,
答案为:CH3OH;O2+4H++4e-=2H2O;1.2;CH3OH +8OH-﹣6e﹣=CO32﹣+6H2O;
(4)用稀硝酸吸收NOx,得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸,说明电解时阳极上亚硝酸根离子失电子生成硝酸根离子,其电极反应式为HNO2-2e-+H2O==NO3-+3H+;
故答案为:HNO2-2e-+H2O==NO3-+3H+。


 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】19.2 g Cu加入到100 mL一定浓度的硝酸溶液中,假定两者恰好完全反应,同时产生标准状况下8.96 L NO和NO2的混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO和NO2的体积比。_____________
(2)硝酸溶液的物质的量浓度。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下框图分析,下列说法正确的是( )
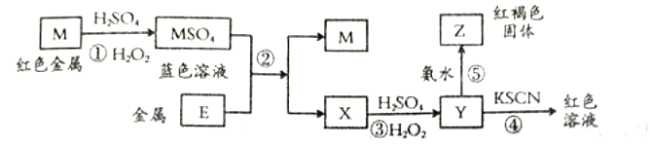
A.![]() 的氧化性比
的氧化性比![]() 的氧化性强
的氧化性强
B.在反应③中若不加稀硫酸可能看到红褐色沉淀
C.反应⑤的离子方程式可表示为![]()
D.在反应①中只能用浓硫酸,既表现酸性,又表现了氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用![]() 和
和![]() 为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
为原料可制备三氯氧磷,其制备装置如图所示(夹持装置略去):
已知![]() 和三氯氧磷的性质如下表:
和三氯氧磷的性质如下表:
熔点 | 沸点 | 其他物理或化学性质 | |
|
|
|
|
|
|
|
(1)仪器乙的名称是__________。
(2)实验过程中仪器丁的进水口为__________(选填“![]() ”或“
”或“![]() ”)口。
”)口。
(3)装置B的作用是__________(填标号)。
a.气体除杂 b.加注浓硫酸 c.观察气体流出速度 d.调节气压
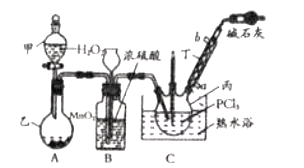
(4)整个装置必须干燥,若未干燥,写出所有副反应的化学方程式______________________________。
(5)制备三氯氧磷所用PCl3测定纯度的方法如下:迅速称取![]() 产品,水解完全后配成
产品,水解完全后配成![]() 溶液,取出
溶液,取出![]() 入过量的
入过量的![]() 碘溶液,充分反应后再用
碘溶液,充分反应后再用![]() 溶液滴定过量的碘,终点时消耗
溶液滴定过量的碘,终点时消耗![]() 溶液。
溶液。
已知:![]() ;
;![]() ;假设测定过程中没有其他反应。根据上述数据,该产品中
;假设测定过程中没有其他反应。根据上述数据,该产品中![]() (相对分子质量为137.5)的质量分数的计算式为__________%。(用含
(相对分子质量为137.5)的质量分数的计算式为__________%。(用含![]() 的代数式表示)
的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用![]() 与
与![]() 合成亚硝酰氯
合成亚硝酰氯![]() ,可以用于有机合成。回答下列问题:
,可以用于有机合成。回答下列问题:
(1)一定条件下,氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及有关反应的热化学方程式如下:
①![]()
②![]()
③![]()
则![]()
![]() __________(用
__________(用![]() 、
、![]() 表示)。
表示)。
(2)![]() 时,在一密闭容器中发生反应:
时,在一密闭容器中发生反应:![]() ,其正反应速率表达式
,其正反应速率表达式![]() 。测得正反应速率和对应浓度的数据如表:
。测得正反应速率和对应浓度的数据如表:
序号 |
|
|
① |
|
|
② |
|
|
③ |
|
|
则![]() __________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
__________达到平衡后,若减小压强,则混合气体的平均相对分子质量将__________(选填“增大”、“减小”或“不变”)。
(3)![]() 时,向体积为
时,向体积为![]() 且带气压计的恒容密闭容器中通入
且带气压计的恒容密闭容器中通入![]() 和
和![]() 发生反应:
发生反应:
![]() 。已知:反应起始和平衡时温度相同。
。已知:反应起始和平衡时温度相同。

①测得反应过程中压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则
所示,则![]() __________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强
__________(选填“>”、“<”或“不确定”)0;若其他条件相同,仅改变某一条件时,测得压强![]() 随时间
随时间![]() 的变化如图1曲线
的变化如图1曲线![]() 所示,则改变的条件是_________。
所示,则改变的条件是_________。
②图2是两位同学描绘的上述反应平衡常数的对数值![]() 与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);
与温度的变化关系图象,其中正确的曲线是______(选填“甲”或“乙”);![]() 的值为______。
的值为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从废钒催化剂中回收钒,既能避免对环境的污染,又能节约宝贵的资源。回收工艺流程如下:
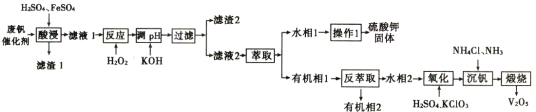
已知:①废钒催化剂中含有K2SO4、V2O5、V2O4、SiO2、Fe2O3、Al2O3等。
②“酸浸”时V2O5和V2O4先与稀H2SO4反应分别生成![]() 和VO2+。
和VO2+。
③有机萃取剂萃取VO2+的能力比萃取![]() 的能力强。
的能力强。
④溶液中![]() 与
与![]() 可相互转化:
可相互转化:![]() 。
。
(1)为了提高“酸浸”效率可采取得措施为______________________。
(2)“酸浸”时加入FeSO4目的是___________,FeSO4参与反应的化学方程式为__________。
(3)“滤渣2”的成分为______________;“操作1”的名称为_______________。
(4)在“氧化”步骤中氧化剂与还原剂的物质的质量之比为1:6,反应的离子方程式为_________________________________________。
(5)t℃时,“氧化”后溶液中c(![]() )=0.1mol/L,假设“沉钒”步骤中
)=0.1mol/L,假设“沉钒”步骤中![]() 全部转化
全部转化![]() ,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(
,并生成NH4VO3沉淀,为使沉钒效率达到95%.则此时溶液中c(![]() )≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
)≥______________。[已知t℃时Ksp(NH4VO3)=2.0×10-3,反应前后溶液的体积变化忽略不计]
(6)取“煅烧”后的V2O5样品m g进行测定,加入足量稀硫酸充分反应后,配成250mL溶液。取该溶液25.00mL用bmol/L草酸溶液进行滴定,消耗草酸溶液cmL。则V2O5样品中钒的质量分数=_________%,样品的纯度≤___________%,样品的纯度小于该数值可能的原因是____________________________。(已知:①V2O5+2H+=2![]() +H2O ②2
+H2O ②2![]() +H2C2O4+2H+=2VO2+2CO2↑+2H2O)
+H2C2O4+2H+=2VO2+2CO2↑+2H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X(g)+3Y(g)![]() 2Z(g),有关下列图像的说法错误的是
2Z(g),有关下列图像的说法错误的是
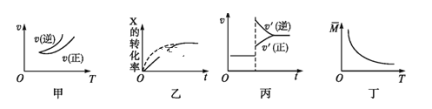
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖可发生如下转化:2CH3CH(OH)COOH(乳酸)![]() C6H12O6(葡萄糖)
C6H12O6(葡萄糖)![]() 2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
2CH3CH2OH+2CO2↑,设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,6.0g葡萄糖和乳酸混合物中氧原子数0.2NA
B.1mol葡萄糖中含有6.0NA个羟基
C.1mol乳酸与足量乙醇反应可生成NA个乳酸乙酯分子
D.相同条件下,相同物质的量的乳酸分别与足量的Na和NaHCO3溶液反应,产生气体的分子数均为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com