
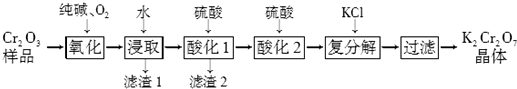
分析 流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾.
(1)若将1mol Cr2O3转化成Na2CrO4,消耗氧气的体积依据电子守恒计算;
(2)依据电离平衡常数和溶度积常数计算所需溶液的PH范围;
(3)操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大;
(4)依据反应过程得到反应的关系式K2Cr2O7~3I2~6Na2S2O3计算产品中重铬酸钾的质量分数.
解答 解:流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾,
(1)若将1mol Cr2O3转化成Na2CrO4,Cr2O3~2Na2CrO4~6e-,O2~4e-,
得到2Cr2O3~3O2~12e-,
2 3
1mol 1.5mol
消耗标准状况下氧气的体积=1.5mol×22.4L/mol=33.6L,
故答案为:33.6;
(2)依据电离平衡常数和溶度积常数计算所需溶液的PH范围,
Al(OH)3(s)?H++AlO2-+H2O的K=c(AlO2-)×c(H+)=1×10-14,c(H+)=10-8mol/L,溶液PH=8,
Kap[Al(OH)3]=c(Al3+)×c3(OH-)=1×10-33 ,c(OH-)=10-9mol/L,c(H+)=10-5mol/L,溶液PH=5,
酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol•L-1,需调节溶液pH值的范围是5~8,
故答案为:5~8;
(3)操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,K2Cr2O7 溶解度小于Na2Cr2O,利用复分解反应,可得到重铬酸钾;
故答案为:K2Cr2O7 溶解度小于Na2Cr2O7;
(4)称取重铬酸钾试样2.40g配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24mol•L-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,
依据反应的定量关系为:
K2Cr2O7~3I2~6Na2S2O3
1 6
0.24mol•L-1 ×0.020L n
n=0.0008mol,
称取重铬酸钾试样2.40g配成250mL溶液中重铬酸钾质量,
m(K2Cr2O7)=0.0008mol×294g/mol×$\frac{250}{25}$2.352g,
产品中重铬酸钾的质量分数=$\frac{2.352g}{2.40g}$×100%=98.0%,
答:产品中重铬酸钾的质量分数=$\frac{2.352g}{2.40g}$×100%=98.0%.
点评 本题考查较为综合,涉及氧化还原反应、溶解平衡以及滴定操作等问题,题目难度中等,本题注意从质量守恒的角度利用关系式法计算.


科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | |||
| 起始浓度 | 5min时浓度 | 起始浓度 | 5min时浓度 | |
| c(CO)/mol/L | 0.1 | 0.08 | 0.2 | x |
| c(H2O)/mol/L | 0.1 | 0.08 | 0.2 | y |
| A. | x=y=0.16 | |
| B. | 反应开始时,乙中反应速率比甲快 | |
| C. | 甲中0~5min的平均反应速率:v(CO)=0.004 mol/(L•min) | |
| D. | 平衡时,乙中H2O的转化率是50%,c(CO)是甲中的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 葡萄可用于酿酒.
葡萄可用于酿酒.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
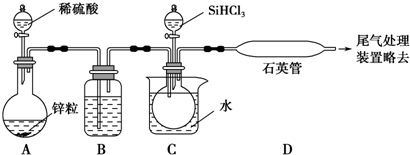
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3(g)═N2(g)+3H2(g)是熵增的反应 | |
| B. | △H、△S分别取“负”时反应一定能自发进行 | |
| C. | 在醋酸溶液中存在两种分子 | |
| D. | 相同温度下,pH值相等的盐酸和醋酸,其浓度是醋酸大于盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
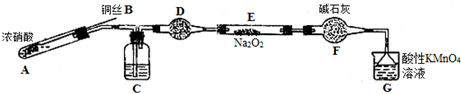
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMnO4溶液体积/mL | 20.70 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②④⑥ | C. | ①③⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com