
【题目】已知氢硫酸是一种二元弱酸,请回答以下问题:
(1)已知 0.1mol/L NaHS 溶液显碱性,则c(S2—)___c(H2S)(填“>”“<”或“=”)。
(2)常温下,向 0.2mol/L的 H2S溶液中逐滴滴入 0.2mol/L NaOH 溶液至中性,此时溶液中以下所示关系不正确的是___(填字母)。
A. c(H+)·c(OH-)=1×10-14
B. c(Na+)=c(HS—)+2c(S2—)
C. c(Na+)> c(HS—)+c(S2—)+ c(H2S)
D. c(H2S)> c(S2—)
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①温度升高时,KSP(CaS ) =___ (填“增大”“减少”或“不变”,下同)。
②滴加少量浓盐酸时,c(Ca2+ )___,原因是___(用文字和离子方程式说明)。
③若向CaS 饱和溶液中加入Cu(NO3)2 溶液中,生成一种黑色固体物质,写出该过程中反应的离子方程式:___。
【答案】< C 增大 增大 加入HCl,增大H+的浓度, H+与S2-结合,降低S2-的浓度,导致CaS(s) ![]() Ca2+(aq)+S2-(aq)溶解平衡正向移动 CaS(s)+Cu(aq)
Ca2+(aq)+S2-(aq)溶解平衡正向移动 CaS(s)+Cu(aq)![]() Ca2+(aq)+CuS(s)
Ca2+(aq)+CuS(s)
【解析】
(1)NaHS 溶液显碱性,水解过程大于电离过程,则c(S2—)<c(H2S);
(2) NaHS 溶液显碱性,根据电荷守恒、物料守恒及水的电离常数只与温度有关来分析判断;
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
根据影响沉淀溶解平衡的条件来分析。
(1)NaHS 溶液中存在电离平衡和水解平衡:HS-![]() H++S2-和HS-+H2O
H++S2-和HS-+H2O![]() H2S+OH-,由于溶液显碱性,所以水解过程大于电离过程,则c(S2—)<c(H2S),
H2S+OH-,由于溶液显碱性,所以水解过程大于电离过程,则c(S2—)<c(H2S),
故本题答案为:<;
(2)A.Kw只与温度有关,常温下,Kw= c(H+)·c(OH-)=1×10-14,故A正确;
B. 根据电荷守恒:c(H+)+c(Na+)=c(HS—)+2c(S2—)+c(OH-),因为c(H+)=c(OH-),所以c(Na+)=c(HS—)+2c(S2—),故B正确;
C. 由于NaHS溶液显碱性,所以要保证溶液呈中性,H2S适当过量,所以根据物料守恒可知,c(Na+)<c(HS—)+c(S2—)+ c(H2S),故C错误;
D. 由于NaHS溶液显碱性,所以要保证溶液呈中性,H2S适当过量,c(H2S)> c(S2—),故D正确。
故本题答案为:C;
(3)已知常温下,CaS 饱和溶液中存在平衡CaS(s) ![]() Ca2+(aq)+S2-(aq) △H>0。
Ca2+(aq)+S2-(aq) △H>0。
①该反应为吸热反应,所以温度升高时, KSP(CaS )增大;
故本题答案为:增大;
②对于平衡CaS(s) ![]() Ca2+(aq)+S2-(aq),滴加少量浓盐酸时,S2-与H+结合,c(S2-) 减小,平衡右移,c(Ca2+ )增大;
Ca2+(aq)+S2-(aq),滴加少量浓盐酸时,S2-与H+结合,c(S2-) 减小,平衡右移,c(Ca2+ )增大;
故本题答案为:增大;加入HCl,增大H+的浓度, H+与S2-结合,降低S2-的浓度,导致CaS(s) ![]() Ca2+(aq)+S2-(aq)溶解平衡正向移动;
Ca2+(aq)+S2-(aq)溶解平衡正向移动;
③CaS悬浊液存在CaS(s) ![]() Ca2+(aq)+S2-(aq)平衡, 若向CaS饱和溶液中加入Cu(NO3)2 溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式为:CaS(s)+Cu(aq)
Ca2+(aq)+S2-(aq)平衡, 若向CaS饱和溶液中加入Cu(NO3)2 溶液,发生复分解反应,生成黑色固体CuS,反应的离子方程式为:CaS(s)+Cu(aq)![]() Ca2+(aq)+CuS(s);
Ca2+(aq)+CuS(s);
故本题答案为:CaS(s)+Cu(aq)![]() Ca2+(aq)+CuS(s)。
Ca2+(aq)+CuS(s)。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:

(1)写出A、B、C、D、E、F的化学式:
A._______;B.______;C.______;
D._______;E.______;F._______。
(2)写出有关反应的化学方程式(是离子反应的直接写出离子方程式)
E![]() B:______
B:______
C![]() F:______
F:______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:![]() ,下列“水”电池在海水中放电时的有关说法正确的是( )
,下列“水”电池在海水中放电时的有关说法正确的是( )
A. 负极反应式:![]()
B. ![]() 不断向“水”电池的正极移动
不断向“水”电池的正极移动
C. 每生成![]() 转移5 mol电子
转移5 mol电子
D. 该电池工作时,电子由![]() 电极向Ag电极移动
电极向Ag电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值,下列说法正确的是( )
A. 常温常压下,31g P4(结构式: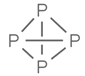 )中所含P-P键数目为1.5NA
)中所含P-P键数目为1.5NA
B. 1L 0.1mol/L硫酸钠溶液中含有的氧原子数为0.4NA
C. 1mol重水与1mol水中,中子数比为2∶1
D. 密闭容器中,2molSO2和1molO2催化反应后分子总数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用 0.1000mol/L KMnO4 酸性溶液滴定未知浓度的无色 H2C2O4 溶液(体积为 20.00mL)。请回答下列问题
(1)该反应的离子方程式是___________________。
(2)盛放高锰酸钾溶液的是___ (填“酸式”或“碱式”)滴定管,其原因是___________________。
(3)滴定终点的现象为______。
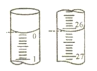
(4)若某次滴定开始和结束时,滴定管中的液面如图所示,则终点的读数为___mL。小明同学根据 3 次实验求得平均消耗高锰酸钾溶液的体积为 VmL,请计算该 H2C2O4溶液的物质的量浓度为___mol/L
(5)下列操作使测定结果偏低的是___(填字母)。
A.酸式滴定管未用标准液润洗直接注入 KMnO4标准液
B.滴定前盛放草酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定后有气泡
D.读取 KMnO4标准液时,开始仰视读数,滴定结束时俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2001年报道硼和镁形成的化合物刷新了金属化合物超导温度的最高记录.如图示意的是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下底面各有一个镁原子,6个硼原子位于棱柱内,则该化合物的化学式可表示为( )
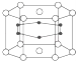
A. MgBB. MgB2C. Mg2BD. Mg3B2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的β″Al2O3陶瓷作固体电解质,反应为2Na+xS![]() Na2Sx。以下说法正确的是( )
Na2Sx。以下说法正确的是( )
A. 放电时,钠作正极,硫作负极
B. 放电时,Na+向负极移动
C. 充电时,钠极与外电源正极相连,硫极与外电源的负极相连
D. 放电时,负极发生的反应是:2Na-2e-===2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。
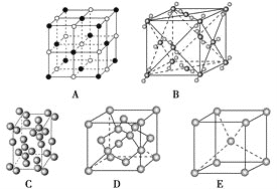
(1)辨别晶胞(请用相应的编号填写)。
①钠晶胞是________;
②碘晶胞是________;
③金刚石晶胞是________;
④干冰晶胞是________;
⑤氯化钠晶胞是________。
(2)与冰的晶体类型相同的是__________。
(3)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ·mol-1,除氢键外,水分子间还存在范德华力(11 kJ·mol-1),则冰晶体中氢键的“键能”是________kJ·mol-1。
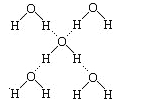
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为 RnH2O,其相对分子质量为 M。25 ℃时,a g 该晶体能够溶 于 b g 水中形成 V mL 饱和溶液。下列关系中不正确的是( )
A.该溶液中溶质的质量分数为 w=![]()
B.该溶液的物质的量浓度为 c=![]()
C.25 ℃时 R 的溶解度为 S= ![]() g
g
D.该溶液的密度为 ρ=![]() g/mL
g/mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com