
【题目】金属具有的通性是( )
①具有良好的导电性②具有良好的传热性③具有延展性④都具有较高的熔点⑤通常状下都是固体⑥都具有很大的硬度
A. ①②③ B. ②④⑥ C. ④⑤⑥ D. ①③⑤
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是( )
A.K+、H+、SO42-、MnO4-B.Na+、Ca2+、Cl-、NO3-
C.Ag+、H+、Cl-、CH3COO-D.Ba2+、K+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取碘水四份于试管中,编号为Ⅰ、Ⅱ、Ⅲ、Ⅳ,分别加入苯、CCl4、酒精、NaCl溶液,振荡后静置,现象正确的是( )
A.Ⅰ中溶液分层,下层呈紫红色B.Ⅱ中溶液分层,下层呈紫红色
C.Ⅲ中溶液分层,下层呈棕黄色D.Ⅳ中溶液分层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白钠镁矾(mNa2SO4·nMgSO4·xH2O)俗称硝板,工业上用白钠镁矾制备碱式碳酸镁[4MgCO3·Mg(OH)2·4H2O]晶须的过程如下:向碳酸钠溶液中加入白钠镁矾,保持50℃加热0.5h,有大量的5MgCO3·3H2O生成,然后升高温度到85℃加热2h发生热解反应,过滤得碱式碳酸镁晶体。
(1)热解反应的方程式为________________。
(2)碱式碳酸镁可用作化学冷却剂,原因是________________。
(3)为测定白钠镁矾的组成,进行下列实验:
①取白钠镁矾3.340 g溶于水配成100.00 mL溶液A;
②取25.00 mL溶液A,加入足量的氯化钡溶液,得BaSO4 1.165 g;
③另取25.00 mL溶液A,调节pH=10,用浓度为0.1000 mol·L-1的EDTA标准溶液滴定Mg2+(离子方程式为Mg2+ + H2Y2-=MgY2-+ 2H+),滴定至终点,消耗标准溶液25.00 mL。通过计算确定白钠镁矾的化学式(写出计算过程)。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用锌冶炼废渣(ZnSO4、CuSO4、FeSO4、FeS2、Al2O3、SiO2)制备ZnSO4和Fe2O3的实验流程如下:

已知:“碱浸”时,NaOH溶液浓度越大越粘稠,越容易生成铝硅酸钠沉淀。
(1) “水浸”阶段需在70~80℃条件下进行,适宜的加热方式为________________。
(2)“氧化”阶段是将Fe2+氧化后进一步生成Fe(OH)3,从反应产物的角度分析,以氯水替代H2O2的缺点是①使ZnSO4中混有ZnCl2;②________________。
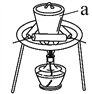
(3)“灼烧”时FeS2发生反应的化学方程式为________________。使用的装置如右图,仪器a的名称为________________。
(4) “碱浸”阶段,在其它条件不变的情况下,所得固体中Fe2O3含量随NaOH溶液的浓度的增大而增大,但当氢氧化钠浓度大于12 mol·L-1时,Fe2O3含量反而降低,其原因是________________。
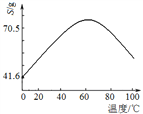
(5)“滤液Ⅰ”溶质主要是ZnSO4和CuSO4。已知硫酸锌晶体的溶解度随温度变化如右图,请设计从“滤液Ⅰ”中获取ZnSO4晶体的实验方案:________________(实验中须使用的试剂有:Zn粉、稀H2SO4、酒精)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K 时,0.1 mol/L H2R溶液中H2R、HR、R2 三种微粒的分布系数δ随 pH 变化的关系如图所示。已知:298 K时,HF的Ka=1.0×103.4。下列表述正确的是
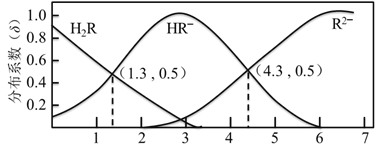
A. H2R的Ka1 = 1.0×101.3
B. Na2R 溶液中离子存在关系:c(Na+) = c(HR ) +2c(R2 )
C. 等物质的量的NaHR 和Na2R溶于水,所得溶液的pH 恰好为4.3
D. 在足量的NaF 溶液中加入少量 H2R 溶液:H2R + 2F = 2HF + R2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①甲烷的燃烧热为 ΔH=—890.3 kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=—517.6 kJ/mol
③2CO(g)+O2(g)=2CO2(g) ΔH=—566kJ/mol
甲烷在一定条件下与CO2反应制备合成气(CO、H2),能实现变废为宝,减少CO2的排放,该反应的热化学方程式为_____________________________________________
(2)燃料电池是应用广泛的新型电池,分析下列燃料电池示意图,按要求书写出电极反应式
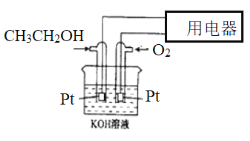
①正极的电极反应式____________________________________________;
②电解质溶液的pH_____________(填“增大”、“减小”或“不变”);
③当电路中转移0.4mol电子时,理论上消耗标准状况下O2的体积为__________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com