
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。
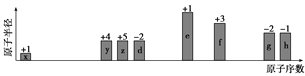
根据判断出的元素及相应化学式回答问题:
(1)f在周期表中的位置是________________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):____________;比较g、h的最高价氧化物对应水化物的酸性强弱:______________。
(3)y形成的最简单气态氢化物的空间构型__________。
科目:高中化学 来源: 题型:
【题目】实验室中常用氧化浓盐酸的方法制取氯气,实验装置如图所示:
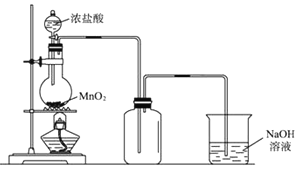
(1)写出制备氯气的离子方程式: ______ ;
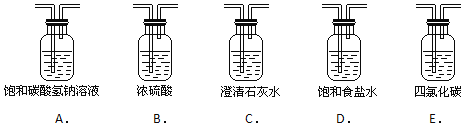
(2)为了得到纯净、干燥的氯气,此装置还需增加净化装置,请根据气体的流动方向,依次按顺序选择所用的装置,正确的选项是 ______ ;
(3)如果将过量二氧化锰与20mL12mol/L的盐酸混合加热,充分反应后生成的氯气明显少于0.06mol,其主要原因有:① ______ ;② ______ .
(4)多余的氯气可以通过下列装置暂时储存后再利用,请选择可以用作氯气的储气的装置 ______ ;
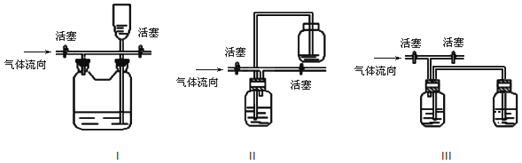
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修3:物质结构与性质]铁氰化钾,化学式为K3[Fe(CN)6],主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)基态K原子核外电子排布简写式为___________。 K3[Fe(CN)6]中所涉及的元素的基态原子核外未成对电子数最多的是_________,各元素的第一电离能由大到小的顺序为_________。
(2)(CN)2分子中存在碳碳键,则分子中σ键与π键数目之比为_______。KCN与盐酸作用可生成HCN,HCN的中心原子的杂化轨道类型为_________。
(3)CO能与金属Fe形成Fe(CO)5,该化合物熔点为253 K,沸点为为376 K,其固体属于_____晶体。
(4)下图是金属单质常见的两种堆积方式的晶胞模型。

①铁采纳的是a堆积方式.铁原子的配位数为_____,该晶体中原子总体积占晶体体积的比值为____(用含π的最简代数式表示)。
②常见的金属铝采纳的是b堆积方式,铝原子的半径为r pm,则其晶体密度为_____g·cm-3(用含有r、NA的最简代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2SO3+I2+H2O == H2SO4+2HI,将0.1mol Cl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是
A. 物质的还原性:HI>H2SO3>HCl
B. H2SO3的物质的量浓度为0.6 mol·L-1
C. 若再通入0.05mol Cl2,恰好能将HI和H2SO3完全氧化
D. 通入0.1mol Cl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。p、q、r是由这些元素组成的二元化合物,常温常压下,p为无色无味气体,q为液态,r为淡黄色固体,s是气体单质。上述物质的转化关系如下图所示。下列说法错误的是

A. 原子半径:Z>Y>X
B. 最简单气态氢化物的稳定性:Y>X
C. m、n、r都含有离子键和共价键
D. m、n、t都能破坏水的电离平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其中B和E同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应。在标准状况下生成11.2LH2;D原子最外层电子数等于其周期序数;E-的电子层结构与Ar原子相同。
(1)D原子结构示意图为______________,B和C形成的化合物电子式为______________。
(2)B和D简单离子的半径大小为______________。(用离子符号和“>”、“=”或“<”表示)
(3)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中不可行的是________ (填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性 ③依据两元素在周期表的位置
④比较原子半径大小 ⑤比较最高价氧化物对应水合物的酸性
(4)E元素能与另外四种元素中的一种元素形成共价化合物,分子中的原子个数比为1∶3,相对分子质量为120.5。则该物质的结构式为__________________________。
(5)关于单质C与冷水反应,下列说法正确的是______________。
①单质C熔化成闪亮的小球,说明该反应是放热反应
②生成H2中含有水蒸汽,液态水变成气态水是吸热反应
③该反应是氧化还原反应,所有氧化还原反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与生产生活关系密切。请完成下列填空:
(1)肼由N、H 两种元素组成,它常用作火箭推进剂。肼的相对分子质量为32,分子中N、H原子的个数比为1∶2,肼的分子式为_____________。16g 肼分子中所含的氮原子数与标准状况下_______L N2中所含的氮原子数相等。
(2)实验室常用下图所示装置制取并收集氨气。

①实验室制取氨气反应的化学方程式为____________________________________;
②图中方框内收集氨气的装置可选用_________________(填字母序号);
③尾气处理装置中使用倒扣漏斗的作用是_________________________________。
(3)在盛有一定量浓硝酸的试管中加入6.4g的铜片发生反应。请回答下列问题:
①开始阶段,反应的化学方程式为____________________________________,若该反应共产生标准状况下气体2.24L,则反应过程中被还原的HNO3的物质的量为_______。
②反应结束后铜片有剩余,再加入少量20%的稀硫酸,这时铜片上又有气泡产生,反应的离子方程式为____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com