
| A. | NH4+浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4溶液浓度由大到小的顺序号:③>②>① | |
| B. | 由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,其离子浓度不可能是:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 若难溶电解质溶解度:A(OH)m大于B(OH)n,则Ksp也一定是前者大 | |
| D. | pH=4浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(104-10-10)mol/L |
分析 A.铵根离子水解程度越大,溶液中铵根离子浓度越小,亚铁离子抑制了铵根离子水解、碳酸根离子促进了铵根离子的水解,据此判断铵根离子浓度相等时该溶液浓度大小;
B.常温下由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,醋酸为弱酸,混合液中醋酸过量,溶液显示酸性,则c(H+)>c(OH-),结合电荷守恒判断各离子浓度大小;
C.对于化学式组成相似的,溶度积常数越大,溶解度也越大,若难溶物的组成形式不同,该关系不一定满足,需要通过计算判断;
D.常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,结合混合液中的电荷守恒、物料守恒进行计算.
解答 解:A.硫酸亚铁铵中,亚铁离子对铵根离子的水解起到抑制作用;碳酸铵中,碳酸根对铵根离子的水解起到促进作用,硫酸根离子不影响铵根离子的水解,所以三种溶液中NH4+浓度相同时,溶液浓度大小为:②>③>①,故A错误;
B.由pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,醋酸过量,溶液显示酸性,则c(H+)>c(OH-),根据电荷守恒可知:c(CH3COO-)>c(Na+),溶液中一定满足:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.对于化学式组成相似的,溶度积常数越大,溶解度也越大,由于A(OH)m和B(OH)n的化学式组成形式不同,所以不能直接根据溶解度大小判断其溶度积,故C错误;
D.常温下,混合液pH=4,c(H+)=1.0×10-4mol/L,则由Kw可知,c(OH-)=1.0×10-10mol/L,由电荷守恒可知:①c(CH3COO-)-c(Na+)=c(H+)-c(OH-),据物料守恒:②2c(Na+)=c(CH3COOH)+c(CH3COO-),①×2+②可得:c(CH3COO-)-c(CH3COOH)=2(c(H+)-c(OH-))=2×(10-4-10-10) mol/L,故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,试题涉及盐的水解原理、难溶物溶度积的应用、离子浓度大小比较等知识,注意掌握盐的水解原理及其影响,明确电荷守恒、物料守恒在判断离子浓度大小中的应用方法.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 结论 |
| A | 由次氯酸可制得盐酸 | 酸性:HClO>HCl |
| B | 原电池中负极金属的活动性,比正极强 | 镁、铝作电极与NaOH溶液组成原电池时,镁作负极 |
| C | -OH可与Na反应生成H2 | 可通过加钠凝聚是否具有气泡产生的方法鉴别乙醇的水溶液和乙酸的水溶液 |
| D | 溶解度小的沉淀易向更小的沉淀转化 | 向AgCl悬浊液中滴加KI溶液可得到AgI沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 热的纯碱溶液去油污效果 更好 | 温度升高,增大了油脂在碳 酸钠溶液中的溶解度 |
| B | 生活中的铝制品经久耐用 | 常温时铝不与氧气反应 |
| C | 氢氧化铁胶体通直流电,阴极颜色变深 | 氛氧化铁胶体带正电荷,在电场力的作用下,胶体向阴极迁移 |
| D | 二氧化破用作通讯光缆 | 二氧化硅对光信号有良好的 传输性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
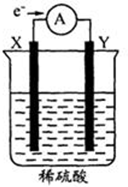 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示.下列关于该装置的判断正确的是( )| A. | 外电路的电流方向为:X→导线→Y | |
| B. | 若两电极都是金属,则它们的活动性顺序为X>Y | |
| C. | X极上发生的是还原反应,Y极上发生的是氧化反应 | |
| D. | 溶液中的SO42-向Y极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
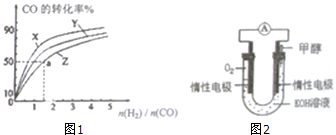 甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.
甲醇既是一种可再生能源,又是一种重要的化工原料.工业上通过CO(g)+2H2(g)?CH3OH(g)生产甲醇.| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 0.5 | 2 | 2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 含氧酸的酸性:H3ZO4>H2YO4>HXO4 | |
| B. | 非金属性:X>Y>Z | |
| C. | 气态氢化物的稳定性按X、Y、Z顺序由弱到强 | |
| D. | 元素的负化合价的绝对值按X、Y、Z顺序由小到大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 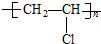 | B. | 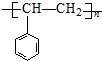 | ||
| C. | 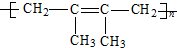 | D. | 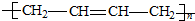 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com