
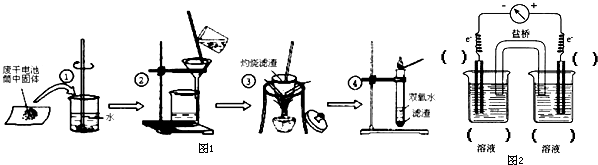
| ||
| ||
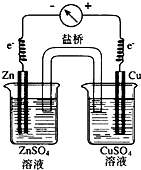 ;
; ;Cu2++2e-=Cu.
;Cu2++2e-=Cu.


科目:高中化学 来源: 题型:
| A、142g |
| B、71g |
| C、0.05mol |
| D、0.025mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
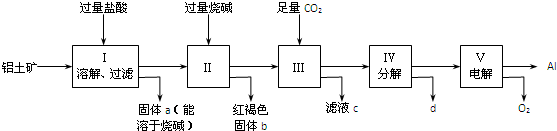
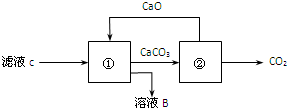
查看答案和解析>>
科目:高中化学 来源: 题型:
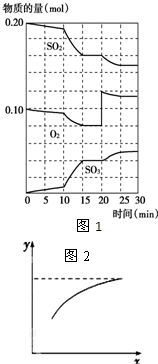 硫酸生产中,接触室内的反应为:
硫酸生产中,接触室内的反应为:
| ||
| △ |
| X | y | |
| A | 再加入SO2 | O2的转化率 |
| B | 再加入SO3 | SO2的体积分数 |
| C | 压强 | 混合气体的物质的量 |
| D | 温度 | 混合气体的平均摩尔质量 |
| 容器 | 甲 | 乙 | 丙 | 丁 |
| 起始投入量 | 2mol SO2+ 1mol O2 | 1mol SO2+ 0.5mol O2 | 2mol SO3 | 2mol SO2+ 2mol O2 |
| 反应放出或 吸收的热量(kJ) | a | b | c | d |
| 平衡时c(SO3)(mol/L) | e | f | g | h |
查看答案和解析>>
科目:高中化学 来源: 题型:
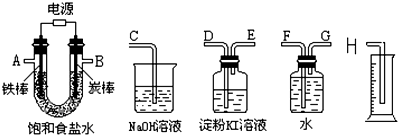
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在100℃、101 KPa条件下,1mol液态水汽化为水蒸气吸收的热量为40.69KJ,则H2O(g)?H2O(l) 的△H=-40.69KJ/mol |
| B、已知MgCO3的Ksp=6.82×10-4mol2/L2,则所有含固体MgCO3的溶液中,都有C(Mg 2+ )=C(CO32-),且 C(Mg2+)?C(CO32-)=6.82×10-4mol2/L2 |
| C、已知:C-C的键能348KJ/mol,C=C的键能610KJ/mol,C-H的键能413KJ/mol, H-H的键能436KJ/mol, 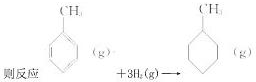 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol 的焓变为:△H=[(4×348+3×610+8×413)+3×436-(7×348+14×413)]=-384 kJ/mol |
| D、碳酸氢钠溶液中存在:c(H*)+c(H2CO3)=c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
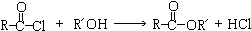
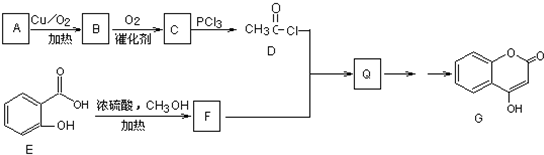
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com