
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
 .
.
分析 A、B、C、D、E是原子序数依次增大的前四周期的常见元素,A的原子半径最小,则A为H元素;B元素原子核外3个能级上的电子数相等,核外电子排布为1s22s22p2,故B为碳元素;D元素原子2p轨道上成对电子数与未成对电子数相等,则核外电子排布为1s22s22p4,则D为O元素;C元素的氢化物的沸点比同族相邻周期元素氢化物的沸点高,分子之间存在氢键,原子序数介于碳、氧之间,则C为N元素;E元素原子N层电子数为1,内层轨道全部排满电子,原子核外电子数为2+8+18+1=29,故E为Cu,据此解答.
解答 解:A、B、C、D、E是原子序数依次增大的前四周期的常见元素,A的原子半径最小,则A为H元素;B元素原子核外3个能级上的电子数相等,核外电子排布为1s22s22p2,故B为碳元素;D元素原子2p轨道上成对电子数与未成对电子数相等,则核外电子排布为1s22s22p4,则D为O元素;C元素的氢化物的沸点比同族相邻周期元素氢化物的沸点高,分子之间存在氢键,原子序数介于碳、氧之间,则C为N元素;E元素原子N层电子数为1,内层轨道全部排满电子,原子核外电子数为2+8+18+1=29,故E为Cu.
(1)E为Cu,原子核外电子数为29,原子基态核外电子排布式为1s22s22p63s23p63d104s1,
同周期随原子序数增大,元素第电负性增大,故电负性C<N<O,
故答案为:1s22s22p63s23p63d104s1;C<N<O;
(2)原子数目相等、价电子总数相等的微粒互为等电子体,与N2互为等电子体的分子有CO,离子有CN-或C22-,
故答案为:CO;CN-或C22-;
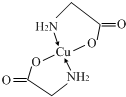
(3)Cu2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),其中E2+离子
与N、O原子间的化学键: ,
,
故答案为: ;
;
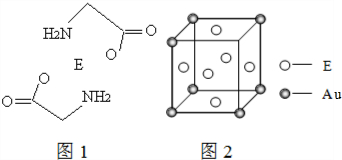
(4)晶胞中Cu原子数目为6×$\frac{1}{2}$=3,Au原子数目为8×$\frac{1}{8}$=1,则该合金的化学式可表示为Cu3Au,
故答案为:Cu3Au.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、等电子体、配合物、晶胞计算等,是对学生综合能力的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制FeSO4溶液时,需加入少量铁粉和稀盐酸,既防止氧化又抑制水解 | |
| B. | 向纯水中加入盐酸或降温都能使电离平衡逆向移动,但水的离子积不变 | |
| C. | 在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去,验证Na2CO3溶液中存在水解平衡 | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸可能过量 | |
| B. | 不溶物中一定含有Fe | |
| C. | 不溶物中一定含有 Cu,但不一定含有Fe | |
| D. | 滤液中一定含有Fe(SO4)3,但不一定含有FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
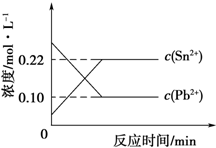 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)?Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示.下列判断不正确的是( )| A. | 25℃时,该反应的平衡常数K=2.2 | |
| B. | 往平衡体系中加入少量 Sn(NO3)2固体后,c(Pb2+)变大 | |
| C. | 往平衡体系中加入少量金属铅后,c(Pb2+)增大 | |
| D. | 升高温度,平衡体系中c(Pb2+)增大,说明该反应△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.
二氧化硫、一氧化碳、氮的氧化物、氨气都是非常重要的非金属化合物,研究这些化合物对环境保护、理解化学反应原理都具有重要意义.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com