
【题目】(1)同温同压下,有两瓶体积相等的CO和CO2,这两种气体中所含的分子数目之比为___,所含的原子总数目之比为___,质量比为___,密度之比为___。
(2)在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,
CuSO4+ SO2↑+ 2H2O反应中,
①______元素被氧化,_______是氧化剂。
②用双线桥标出该反应电子转移的方向和数目。
Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O
CuSO4+ SO2↑+ 2H2O
③若有2.4mol的H2SO4参与反应,则被还原的H2SO4为___g,生成标况下的二氧化硫气体_______ L,转移电子的数目为_______________。(NA表示阿伏加德罗常数的值)
【答案】 1:1 2:3 7:11 7:11 铜元素,浓硫酸 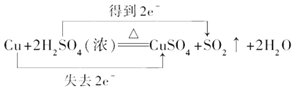 117.6g 26.88L 2.4NA(或者1.4448×1024)
117.6g 26.88L 2.4NA(或者1.4448×1024)
【解析】(1)同温、同压下体积相等的气体,气体的物质的量相等,即分子数目相等,所以CO和CO2分子数目之比为1:1;物质的量相等的CO和CO2所含的原子总数目之比为2:3;物质的量相等的CO和CO2的质量比等于气体的摩尔质量之比,即:28:44=7:11,气体的密度之比等于气体摩尔质量之比,即:28:44=7:11;正确答案:1:1; 2:3 ;7:11;7:11。
(2) ①在Cu + 2H2SO4(浓) ![]() CuSO4+ SO2↑+ 2H2O反应中,铜做还原剂,被氧化,浓硫酸做氧化剂,被还原,所以Cu元素被氧化,浓硫酸是氧化剂;正确答案:铜元素;浓硫酸。
CuSO4+ SO2↑+ 2H2O反应中,铜做还原剂,被氧化,浓硫酸做氧化剂,被还原,所以Cu元素被氧化,浓硫酸是氧化剂;正确答案:铜元素;浓硫酸。
②1molCu在反应中失去2mol电子,1mol H2SO4在反应中得到2 mol电子,因此用双线桥标出该反应电子转移的方向和数目如下: ;正确答案:
;正确答案: 。
。
③2molH2SO4(浓) 参与反应,做氧化剂的硫酸为1mol,若有2.4mol的H2SO4参与反应,则被还原的H2SO4为1.2mol,质量为1.2×98=117.6 g;2molH2SO4(浓) 参与反应,生成二氧化硫1mol,若有2.4mol的H2SO4参与反应,生成二氧化硫1.2mol,标况下体积为26.88L;2molH2SO4(浓) 参与反应,转移电子2mol,若有2.4mol的H2SO4参与反应,转移电子数为2.4NA;正确答案:117.6g;26.88L ; 2.4NA(或者1.4448×1024)。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案科目:高中化学 来源: 题型:
【题目】两份质量相等的SO2和SO3,下列说法正确的是( )
A. 氧原子的物质的量之比是1:1
B. 硫原子的物质的量之比是5:4
C. 氧元素的质量之比是3:2
D. 硫元素的质量之比是1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水体中重金属铅的污染问题备受关注。查资料知Pb4+具有很强的氧化性,水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2( 在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量分数a随溶液pH变化的关系如下图所示:

下列有关说法正确的是
A. Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)=1/2
B. 向Pb(NO3)2波中滴加氯化铵溶液,溶液中c(Pb2+)/c(NO3-)变小,可能是Cl-与Pb2+发生反应
C. 向Pb(NO3)2溶液中滴加NaOH溶液,pH 越大,生成沉淀越多
D. pH=12时,混合体系中发生的主要反应的离子方程式为Pb(OH)3-+OH-=Pb(OH)42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH的电离常数K=1.6×10﹣5 . 该温度下,向20mL 0.01molL﹣1 CH3COOH溶液中逐滴加入0.01molL﹣1 KOH溶液,回答下列有关问题:
(1)醋酸溶液中c(H+)为 , pH约为 .
(2)用滴定管取CH3COOH溶液20.00mL放在锥形瓶中,滴加几滴酚酞,待测.滴定管在使用前除洗涤外,还应 .
(3)判断到达滴定终点的实验现象是;
(4)下列操作中,可能使所测CH3COOH溶液的浓度偏低的是
A.碱式滴定管未用标准碱液润洗就直接注入标准液
B.读取碱液体积时,开始仰视读数,滴定结束时俯视读数
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.滴定前盛放CH3COOH溶液的锥形瓶用蒸馏水洗净后没有干燥.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的( )
A.乙醇和浓硫酸加热到140℃制取乙烯
B.乙烷和氯气光照下制取纯净的氯乙烷
C.在苯和溴水的混合物中加入铁粉制取溴苯
D.用酸性高锰酸钾溶液区分  和
和 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请同学们根据官能团的不同对下列有机物进行分类.把正确答案填写在题中的横线上①CH3CH2OH② ![]() ③CH3CH2Br④
③CH3CH2Br④ ![]() ⑤
⑤ ![]() ⑥
⑥ ![]() ⑦
⑦ ![]() ⑧
⑧ ![]() ⑨
⑨ ![]() ⑩
⑩ ![]()
(1)芳香烃:;
(2)卤代烃:;
(3)醇:;
(4)酚:;
(5)醛:;
(6)酮:;
(7)羧酸:;
(8)酯: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图所示的实验装置来粗略测定电石中碳化钙的质量分数.
(1)烧瓶中发生反应的化学方程式是 . 装置B和C的作用是 . 烧瓶要干燥,放人电石后应塞紧橡皮塞,这是为了
(2)所用电石质量不能太大,否则;也不能太小,否则 . 若容器B的容积为250mL,则所用的电石质量应在g左右.(从以下数据选填:0.30、0.60、1.00、1.50、2.00)
(3)为了得到比较平稳的乙炔气流,常可用代替水.
(4)实验中测得排入量筒中水的体积为V mL(1.01×105 Pa,0℃),电石质量为W g.则电石中碳化钙的质量分数是 . (不计导管中残留的水,气体中饱和水蒸气可忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F均为短周期元素,原子序数依次递增.A元素原子核内无中子.B元素原子核最外层电子数是次外层电子数的2倍.C元素是地壳中含量最多的元素.D是短周期元素中金属性最强的元素.E与F的位置相邻,F的最高价氧化物的水化物为最强酸.
(1)推断B在元素周期表中的位置:第周期,第族.
(2)写出F的电子排布式: .
(3)C、D可形成淡黄色的粉末,其电子式为 .
(4)写出A与C形成的10电子微粒的化学式:、、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在托盘天平的两盘,放上质量相等的A、B两烧杯,调至平衡,然后分别倒入质量相等的足量盐酸,继而在AB两烧杯中放入下述各组物质,结果天平仍保持平衡的是()
A. 0.8molNa和0.5molMg B. 0.1molZn和0.1molAl
C. 8.4gMgCO3和8.4gNaHCO3 D. 10gCaCO3和10gMgCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com