
A、NaCl→Cl2 B、Fe3+→Fe2+ C、Cu2+→Cu D、H+→H2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
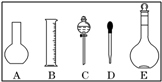 实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL,需要0.5mol/L硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
(17分)实验室需要0.1 mol/L NaOH溶液450 mL,需要0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(4)取用任意体积的所配0.5 mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省涟水中学高二5月学分认定模块检测化学试卷(带解析) 题型:填空题
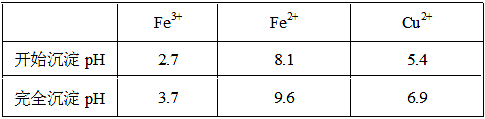
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。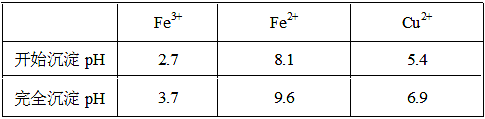
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。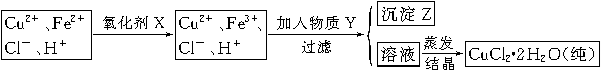
①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
| A.NaClO | B.H2O2 | C.KMnO4 | D.HNO3 |
查看答案和解析>>
科目:高中化学 来源:2014届江苏省高二5月学分认定模块检测化学试卷(解析版) 题型:填空题
已知金属离子从开始形成氢氧化物沉淀到沉淀完全时溶液的pH。
(1)实验室配制FeCl2溶液时需加入少许盐酸和铁粉,若只加盐酸、不加铁粉,溶液中会发生什么变化,用离子方程式表示为: ;
(2)氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。
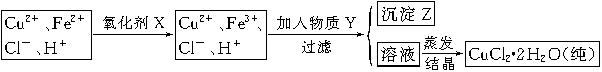
①加氧化剂X的目的是 ,下列氧化剂中最适合作氧化剂X的是 (填序号);
A.NaClO B.H2O2 C.KMnO4 D.HNO3
②物质Y的化学式是 ;加入物质Y的目的是调节溶液的pH至a,使Fe3+沉淀完全,则a的范围是 ;若25℃时,a=3的溶液中,c(Fe3+)= mol·L-1。(25℃时,Ksp[Fe(OH)3]=4.0×10-38)
(3)欲将CuCl2·2H2O加热制得无水CuCl2,将采用什么方法和措施?__________。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高一上学期期中考试化学卷 题型:填空题
(17分)实验室需要0.1 mol/L NaOH溶液450 mL,需要0.5 mol/L硫酸溶液500 mL.根据这两种溶液的配制情况回答下列问题:
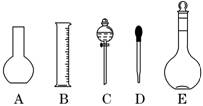
(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),配制上述溶液还需用到的玻璃仪器是 (填仪器名称).
(2)根据计算用托盘天平称取NaOH的质量为 g.
(3)根据计算得知,所需质量分数为98%、密度为1.84 g/cm3的浓硫酸的体积为
mL(计算结果保留一位小数).如果实验室有15 mL、20 mL、50 mL量筒,应选用 mL的量筒最好.配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是 。
(4)取用任意体积的所配0.5 mol/L硫酸溶液时,下列物理量中不随所取体积的多少而变化的是(填字母)
A.溶液中H2SO4的物质的量 B.溶液的浓度
C.溶液中SO42-的数目 D.溶液的密度
(5)将所配制的稀H2SO4进行测定,发现浓度大于0.5mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.用量筒量取浓硫酸时,仰视量筒的刻度
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com