
| A. | 石蕊试纸和pH试纸使用前都必须用蒸馏水润湿 | |
| B. | 沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变 | |
| C. | 电离和水解反应都是吸热过程 | |
| D. | 酸式盐的pH均小于7 |
分析 A.pH试纸不能湿润;
B.沉淀溶解达到平衡时,为动态平衡,离子浓度不变;
C.加热可促进电离平衡、水解平衡正向移动,电离时化学键断裂吸热;
D.碳酸氢钠水解显碱性.
解答 解:A.pH试纸不能湿润,否则可能产生误差,而石蕊试纸使用前用蒸馏水润湿,故A错误;
B.沉淀溶解达到平衡时,为动态平衡,离子浓度不变,但离子浓度不一定相等,与物质构成有关,故B错误;
C.加热可促进电离平衡、水解平衡正向移动,电离时化学键断裂吸热,则电离和水解反应都是吸热过程,故C正确;
D.碳酸氢钠水解显碱性,硫酸氢钠溶液电离显碱性,则酸式盐的pH不一定小于7,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握试纸的使用、沉淀溶解平衡、水解与电离等为解答该题的关键,侧重分析与实验能力的考查,注意实验的评价性分析,选项B为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 叙述Ⅰ | 叙述Ⅱ |
| A | NaCl是离子化合物 | NaCl固体可导电 |
| B | 原电池可将化学能转化为电能 | 原电池需外接电源才能工作 |
| C | 1-己醇的沸点比己烷的沸点高89℃ | 1-己醇和己烷可通过蒸馏初步分离 |
| D | 乙二酸可与KMnO4溶液发生反应 | 乙二酸具有酸性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ② | C. | ③ | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 形成amolCaCO3 | |
| B. | 形成bmolCaCO3 | |
| C. | 可能得到CaCO3沉淀,但沉淀量小于bmol | |
| D. | 可能最终得到澄清溶液,其中含$\frac{a}{2}$molCa2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
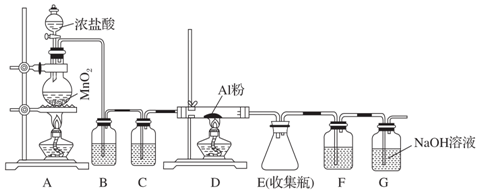
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 35Cl原子所含质子数为18 | |
| B. | 35Cl2气体的摩尔质量为70 | |
| C. | 3.5g的35Cl2气体的体积为2.24L | |
| D. | 1/18mol的H35Cl分子所含中子数约为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和铁都是热和电的良导体 | |
| B. | 棉纱和蚕丝都属于蛋白质 | |
| C. | 玻璃和光导纤维都是硅酸盐材料 | |
| D. | 聚乙烯和聚氯乙烯都可制成食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质活泼性:C2>B2>A2 | B. | 还原性:A->B->C- | ||
| C. | 氧化性:A2>B2>C2 | D. | 反应:A2+2C-=2A-+C2不能发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com