
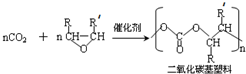
 (-R、-R′代表烃基或氢原子)
(-R、-R′代表烃基或氢原子)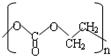 的单体是CO2和
的单体是CO2和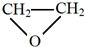 .
.
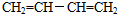 ,名称是1,3-丁二烯.
,名称是1,3-丁二烯.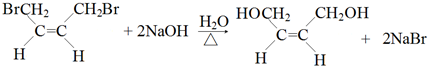 .
.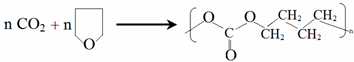 .
.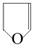 .
.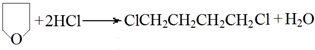 .
.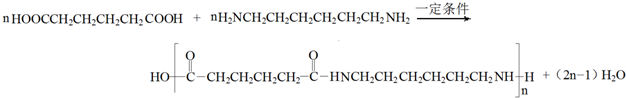 .
. 分析 (1)比较该反应的反应物和生成物结构简式可知,该反应为二氧化碳中的一个碳氧双键与另一反应物发生加聚反应,据此答题;
(2) 为加聚反应的产物,根据加聚反应的原理可知其单体;
为加聚反应的产物,根据加聚反应的原理可知其单体;
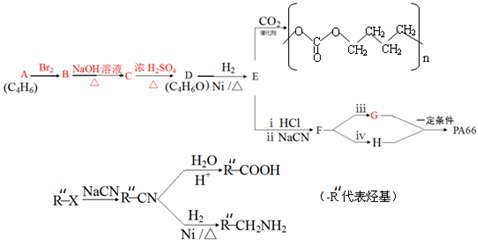
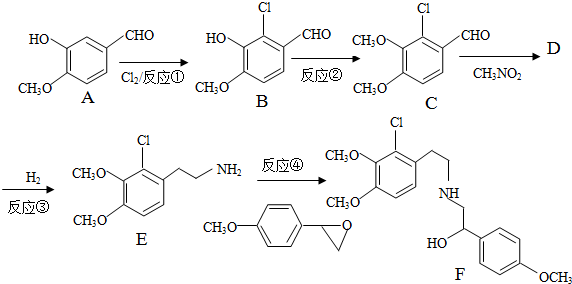
(3)(4)(5)A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,结合A的分子式可知,A为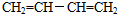 ,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为
,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为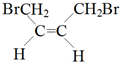 ,B发生水解得C为
,B发生水解得C为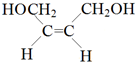 ,C在浓硫酸作用下生成D为
,C在浓硫酸作用下生成D为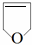 ,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为
,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为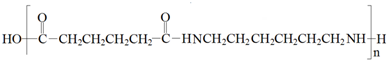 ,据此答题;
,据此答题;
解答 解:(1)比较该反应的反应物和生成物结构简式可知,该反应为二氧化碳中的一个碳氧双键与另一反应物发生加聚反应,
故答案为:加聚;
(2) 为加聚反应的产物,根据加聚反应的原理可知其单体为CO2和
为加聚反应的产物,根据加聚反应的原理可知其单体为CO2和 ,
,
故答案为:CO2和 ;
;
A、B、C分子均为直链结构,且A、B的核磁共振氢谱都只有两个峰,峰面积之比为1:2,结合A的分子式可知,A为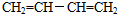 ,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为
,根据E与二氧化碳发生加聚反应的产物结构可知E为环氧丁烷,根据转化关系可知,B是顺式结构,A与溴发生1,4-加成得B为 ,B发生水解得C为
,B发生水解得C为 ,C在浓硫酸作用下生成D为
,C在浓硫酸作用下生成D为 ,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为
,D与氢气加成得E,1molG可与NaHCO3溶液反应产生44.8LCO2(标准状态下),说明G中有两个羧基,所以1mol环氧丁烷 与2mol HCl反应再与NaCN反应生成F为NCCH2CH2CH2CH2CN,F酸性水解得G为HOOCH2CH2CH2CH2COOH,F与氢气发生加成反应得H为H2NCH2CH2CH2CH2CH2CH2NH2,G和H发生缩聚反应得PA66为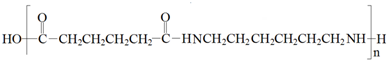 ,
,
(3)①根据上面的分析可知,A为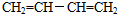 ,其名称为1,3-丁二烯,
,其名称为1,3-丁二烯,
故答案为: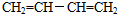 ;1,3-丁二烯;
;1,3-丁二烯;
②B为 ,B→C的化学方程式是
,B→C的化学方程式是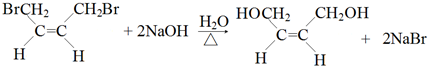 ,
,
故答案为: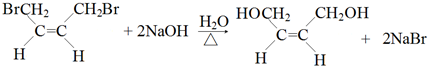 ;
;
③E为环氧丁烷,由E制备二氧化碳基塑料的化学方程式是 ,
,
故答案为: ;
;
(4)D为 ,D的一种同分异构体在相同条件下也能制得E,其结构简式是
,D的一种同分异构体在相同条件下也能制得E,其结构简式是  ,
,
故答案为: ;
;
(5)①1mol E与2mol HCl反应的化学方程式是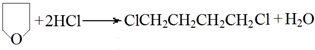 ,②G和H在一定条件下生成PA66的化学方程式是
,②G和H在一定条件下生成PA66的化学方程式是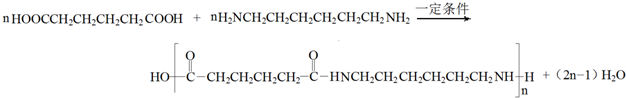 ,
,
故答案为: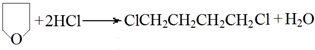 ;
;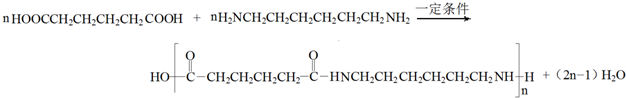 .
.
点评 本题考查有机物推断,需要学生对给予的信息进行利用,能较好的考查学生自学能力,注意根据A的分子式与E的结构进行推断,注意掌握官能团的性质与转化,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | SiO2既能与HF反应,又能与NaOH反应,属于两性氧化物 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 氯化铝是一种电解质,可用于电解制铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
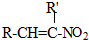 +H2O
+H2O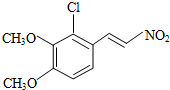 ,反应③中1摩尔D需要4摩尔H2才能转化为E
,反应③中1摩尔D需要4摩尔H2才能转化为E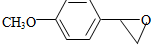 很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式
很多种同分异构体,请写出符合下列条件的一种同分异构体的结构简式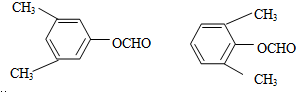 .
.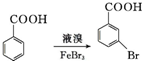 .写出以
.写出以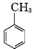 为原料制备
为原料制备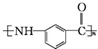 的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)
的合成路线流程图(无机试剂任选).(合成路线常用表示方法为:A$→_{反应试剂}^{反应试剂}$B …$→_{反应试剂}^{反应试剂}$目标产物)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
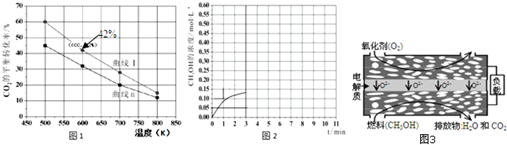
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S的燃烧热为 297.2 kJ/mol | |
| B. | S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ | |
| C. | S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ | |
| D. | 形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量氢氧化钠溶液后产生的浑浊不溶解 | |
| B. | 用pH试纸检验呈弱酸性 | |
| C. | 滴入KSCN溶液后溶液变血红色 | |
| D. | 溶液显浅黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | Fe3+ | Cu2+ | SO42- | Na+ | H+ |
| 浓度/(mol/L) | 2×10-3 | 1×10-3 | 1×10-2 | 2×10-3 |
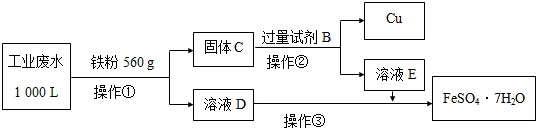
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.2% | B. | 30.0% | C. | 75.7% | D. | 80.6% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com