
������֮���ת����ϵ����ͼ������������ʡ�ԡ�C��D����X��Y��Z������Ԫ����ɵĻ����X��Y��Z��ԭ�������������������ڱ���X��ԭ�Ӱ뾶��С��Y��Zԭ������������֮��Ϊ10��DΪ��ɫ�ǿ�ȼ�����壬GΪ����ɫ�������壬J��MΪ������I��Ư�����ã���Ӧ�ٳ���������ӡˢ��·�塣
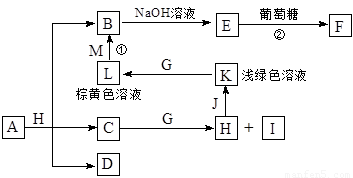
��ش��������⣺
��1��д��A�Ļ�ѧʽ______________��C�ĵ���ʽ______________��
��2���Ƚ�Y��Z��ԭ�Ӱ뾶��С��_________��_______����дԪ�ط��ţ���
��3����֪F����ϡ���ᣬ��Һ�����ɫ���ų���ɫ���塣��д���÷�Ӧ�Ļ�ѧ����ʽ
_______________________________________________��
��4���о�����������D��һ�������¿ɱ���ԭΪ��Ө���ľ���N����ṹ��ԭ�ӵ�����Ϊ�������壬��д��N����2��ͬ�������������____��______��_______��
 ʱ�����������ҵԭ���ܳ�����ϵ�д�
ʱ�����������ҵԭ���ܳ�����ϵ�д� ����νӽ̲���ĩ���Ԥϰ�人������ϵ�д�
����νӽ̲���ĩ���Ԥϰ�人������ϵ�д� ������ҵ��ٳɳ����½������������ϵ�д�
������ҵ��ٳɳ����½������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ||
| ||
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
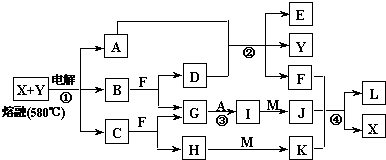
 ��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ����
��2012?����һģ����֪AΪ��ѧ��ѧ�е�һ���Σ�B��CΪ�ճ������г����Ľ�����ͨ��������D��GΪ��ɫ��ζ���壮��֪�ö��Ե缫���A��Һһ��ʱ�����ֻ��C��D��E��ϡ��Һ��������֮���ת����ϵ��ͼ�����ַ�Ӧ��������ȥ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

 ]2-Na+
]2-Na+ ]2-Na+
]2-Na+
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com