
【题目】一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( ) A.2 mol C
B.2 mol A、2mol B和1 mol He(不参加反应)
C.1 mol B和1 mol C
D.2 mol
A.3 mol B和3 mol C
【答案】A
【解析】解:反应2A(g)+B(g)3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,就是等效平衡,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%,
A.2molC相当于 ![]() molA和
molA和 ![]() molB,二者的比值为2:1,大于1:1,则平衡后A的体积分数大于a%,故A正确;
molB,二者的比值为2:1,大于1:1,则平衡后A的体积分数大于a%,故A正确;
B.2molA、2molB和1molHe(不参加反应),n(A):n(B)=2:2,等于1:1,则平衡后A的体积分数等于a%,故B错误;
C.1molB和1molC,相当于 ![]() molA和
molA和 ![]() molB,n(A):n(B)=1:2,小于1:1,则平衡后A的体积分数小于a%,故C错误;
molB,n(A):n(B)=1:2,小于1:1,则平衡后A的体积分数小于a%,故C错误;
D.2molA、3molB和3molC,相当于4molA和4molB,二者的比值为4:4,等于1:1,则平衡后A的体积分数等于a%,故D错误,
故选A.
反应2A(g)+B(g)3C(g)中,气体的体积前后相同,在一定温度下,在恒容密闭容器中得到平衡状态,只要满足物质全部转化为A、B,且满足n(A):n(B)=1:1,即可得到相同平衡状态,结合浓度对平衡移动的影响,只要加入的物质的量:n(A):n(B)>1:1,平衡后A的体积分数大于a%.


科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是:( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 验证FeCl3对H2O2分解反应有催化作用 | 验证单质氧化性: Cl2>Br2>I2 | 加热至混合液呈红褐色,停止加热,制备Fe(OH)3胶体 | 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液.在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示. 
(1)据图可知,反应时需要控制的适宜温度是℃,要达到此要求需要采取的措施是 .
(2)已知:黄铁矿中的硫元素在酸性条件下可被ClO3﹣氧化成SO42﹣ , 请写出制备二氧化氯(ClO2)的离子方程式: .
(3)该校化学学习小组拟以“ ![]() ”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
”作为衡量ClO2产率的指标.若取NaClO3样品6.0g,通过反应和吸收获得400mL ClO2溶液,取此溶液20mL与37.00mL 0.500molL﹣1 (NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0molL﹣1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL.反应原理为: 4H++ClO2+5Fe2+═Cl﹣+5Fe3++2H2O
14H++Cr2O72﹣+6Fe2+═2Cr3++6Fe3++7H2O
试计算ClO2的“产率”(写出计算过程).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在体积为2L的密闭容器中充入1mol A和b mol B气体,发生如下反应:A(g)+B(g)2C(g),5min后反应达到平衡时n(A)为0.4mol.在反应过程中体系的温度持续升高,实验测得混合气体中C的含量与温度的关系如下图所示.下列叙述正确的是( ) 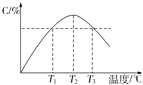
A.0~5 min,C物质的平均反应速率为0.04 molL﹣1min﹣1
B.图中温度T1时的正反应速率等于温度T3时的正反应速率
C.该反应温度T2时的平衡常数大于温度T3时的平衡常数
D.图中T2时,若只增大压强,则正、逆反应速率不改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在生物体内含量极少,但必不可少的化学元素有 ( )
A. Fe Mn Zn Mg
B. Zn Cu Mn Ca
C. Zn Cu B Fe
D. H O Na Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是一种重要的化工产品,是生产铵盐、尿素等原料,工业合成氨的反应如下: N2(g)+3H2(g)2NH3(g)△H=一92.4KJmol﹣1
(1)已知H2(g)的燃烧热为285KJ/mol,写出NH3(g)在纯氧中燃烧生成无毒、无害物质的热化学方程式.
(2)25℃时,将a mol (NH4)2SO4溶于水,向该溶液中滴加V L稀氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将(填“正向”、“不”或“逆向”)移动,所滴加稀氨水的物质的量浓度为molL﹣1 . (25℃时,NH3H2O的电离平衡常数Kb≈2×10﹣5)
(3)工业上常通过如下反应合成尿素[CO(NH2)2]: CO2(g)+2NH3(g)CO(NH2)2(l)+H2O(g)△H<0,t℃时,向容积恒定为2L的密闭容器中加入0.10molCO2和0.40molNH3 . 反应中CO2( g)的物质的量随时间变化如表所示:
时间/min | 0 | 30 | 70 | 80 | 100 |
n(CO2)/mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
①20min时,υ正(CO2 )80min时.υ逆(H2O)(填“>”、“=”或“<”).在t℃时,该反应额平衡常数表达式为K=;
②在100min时,保持其它条件不变,再向容器中充入0.050mo1CO2和0.20molNH3 , 重新建立平衡后CO2的转化率与原平衡相比将(填“增大”、“不变”或“减小”).
③上述可逆反应的平衡常数为(保留二位小数).
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图象;保持其它条件不变;则(t+10)℃下正确的图象可能是(填图甲中的“A”或“B”). 
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气.该装置中阳极的电极反应式为 , 若两极共收集到气体22.4L(标况),则消耗的尿素为g(忽略气体的溶解).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com