
| A. | Na+、K+、S2-、Cl- | B. | Al3+、Mg2+、SO42-、Cl- | ||
| C. | K+、Na+、SiO32-、NO3- | D. | K+、Na+、SO42-、CO32- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
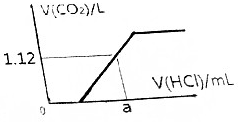 取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.
取Na2CO3和NaHCO3的混合物8.22g,加热到质量不再发生变化,冷却后称其质量为6.36g.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 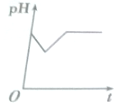 | B. | 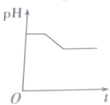 | C. | 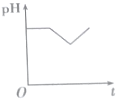 | D. | 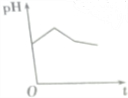 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醛基的结构简式:-CHO | B. | 甲烷的电子式: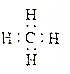 | ||
| C. | 乙炔分子的结构式:H-C≡C-H | D. | 乙醇的分子式:C2H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-) | |
| B. | 物质的量浓度相等的①NH4Cl②(NH4)2SO4③NH4HSO4溶液中,c(NH4+)大小顺序为:③>②>① | |
| C. | 等体积,等物质的量浓度的Na2S溶液与NaHS溶液混合后:3c(Na+)=2c(S2-)+2c(HS-)+2c(H2S) | |
| D. | 等体积、等物质的量浓度的Na2SO3溶液与HCl溶液混合后:c(H+)+c(H2SO3)═c(SO32-)++c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,在NH4Cl溶液中离子浓度大小顺序为c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com