
 )中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.
)中加入金属Ga,得到的盐是一种新型气体发生剂,常用于汽车安全气囊.分析 (1)Ga是31号元素,其核外有31个电子,根据构造原理写出其核外电子排布式;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大;共价单键是σ键,共价双键中一个是σ键一个是π键;
(3)根据价层电子对互斥理论确定其空间构型;
(4)①a.等电子体的价层电子数相等;
b.同周期元素从左到右第一电离能逐渐增大;
c.同周期元素从左到右电负性逐渐增大;
d.根据砷和Cu的价层电子特点判断;
②根据反应物、生成物结合反应条件可书写化学方程式;利用价层电子对互斥模型判断分子的空间构型可杂化方式;
③从是否形成氢键的角度分析.
解答 解:(1)Ga是31号元素,其核外有31个电子,根据构造原理知,其核外电子排布式为:[Ar]3d104s24p1或1s22s22p63s23p63d104s24p1,
故答案为:[Ar]3d104s24p1 或1s22s22p63s23p63d104s24p1;
(2)该物质中含有C、N、H三种元素,吸引电子能力越强的元素其电负性越大,吸引电子能力大小顺序是N>C>H,所以其电负性大小顺序是N>C>H;
共价单键是σ键,共价双键中一个是σ键一个是π键,所以该分子中含有9个σ键,所以在1mol 5-氨基四唑中含有的σ键的数目为 9NA,
故答案为:N>C>H;9NA;
(3)N3-中价层电子对=2+$\frac{1}{2}$(5+1-2×3)=2,且该离子中不含孤电子对,所以其空间构型是直线形,故答案为:直线形;
(4)①a.GaP的价层电子为3+5=8,SiC的价层电子为4+4=8,GaAs价层电子数为3+5=8,则为等电子体,故a正确;
b.同周期元素从左到右第一电离能逐渐增大,则第一电离能:As>Ga,故b错误;
c.同周期元素从左到右电负性逐渐增大,则电负性:As>Ga,故c正确;
d.砷的价层电子为sp电子,位于周期表p区,而Cu的外围电子排布为3d104s1,属于ds区元素,故d错误;
故答案为:ac;
②(CH3)3Ga中Ga形成3个δ键,没有孤电子对,为sp2杂化,故答案为:sp2;
③N原子半径较小,电负性较大,对应的NH3分子间能形成氢键,沸点较高,而As电负性小,半径大,分子间不能形成氢键,沸点较低,
故答案为:NH3分子间能形成氢键,而As电负性小,半径大,分子间不能形成氢键.
点评 本题考查位置、结构与性质关系的应用,题目难度中等,涉及元素周期律的递变规律、分子空间构型以及杂化类型的判断、电子排布式以及氢键等知识,注意相关基础的把握和方法的积累.


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
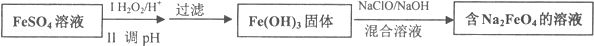
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
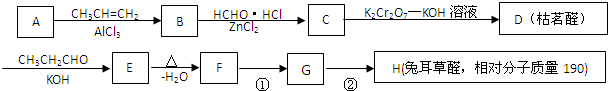
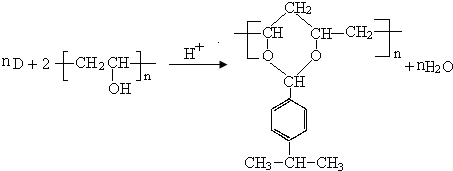
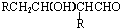 $→_{-H_{2}O}^{△}$
$→_{-H_{2}O}^{△}$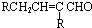
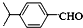 .
.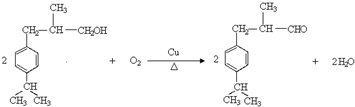 .
.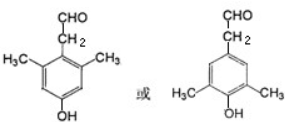 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定有Al3+、Mg2+、NH4+、SO32-、Br | B. | 肯定有Mg2+、Br-、HCO3-、SO42- | ||
| C. | 肯定无Ag+、Cl-、I-、AlO2-、MnO4 | D. | 可能有K+、Cl-、SO42-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,使煤和氢气作用,可以得到液体燃料,也可以获得洁净的燃料油 | |
| B. | (CH3)2CHCH(CH3)2的系统命名为:2,3-二甲基丁烷 | |
| C. | 硬脂酸甘油酯可以在稀硫酸中水解,也可以在NaOH溶液中发生皂化反应彻底水解 | |
| D. | 氨基酸分子中均含有氨基和羧基,加入浓的硫酸钠溶液可从溶液中析出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
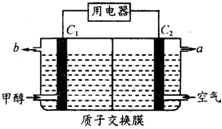 燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )| A. | b口放出气体为CO2 | |
| B. | 质子将由C1电极区经交换膜向C2电极区运动 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3 molCu | |
| D. | 电池总反应的产物与甲醇燃烧产物一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物就是仅有碳、氢两种元素组成的化合物 | |
| B. | 有机物都是非电解质,不能导电 | |
| C. | 组成符合CnHn的有机物分子一定互为同系物 | |
| D. | 含有醛基(-CHO)的有机物不一定是醛 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com