
丙烯醛的结构简式为CH2===CH—CHO。下列关于它的性质的叙述中错误的是( )
A.能使溴水褪色,也能使酸性高锰酸钾溶液褪色
B.在一定条件下与H2充分反应,生成1丙醇
C.能发生银镜反应表现出氧化性
D.在一定条件下能被空气氧化
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
可以增加反应物分子中活化分子的百分数的是①反应反应的浓度 ②增大压强 ③升高温度 ④使用催化剂 ⑤减小压强 ⑥降低温度( )
|
| A. | ①②③④ | B. | ②③ | C. | ③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某澄清、透明的浅黄色溶液中,可能含有下列八种离子:Na+、NH4+、Fe3+、Ba2+、Al3+、SO42﹣、HCO3﹣、I﹣,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )
A. 4种 B. 5种 C. 6种 D. 7种
查看答案和解析>>
科目:高中化学 来源: 题型:
向5.2g Fe3O4、Fe2O3、Cu的混合物中加入0.5mol•L﹣1的硫酸溶液140mL时,固体恰好完全溶解,所得溶液中不含Fe3+,若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为( )
A. 1.12g B. 6.42g C. 2.24g D. 3.24g
查看答案和解析>>
科目:高中化学 来源: 题型:
若有A、B、C三种烃的衍生物,相互转化关系如下:
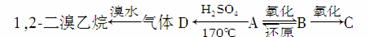
跟石灰石反应产生使石灰水变浑浊的气体。
(1)A、B、C中所含官能团的名称是__________、________、________。
(2)书写下列反应的化学方程式:
A―→B的化学方程式为
________________________________________________________________________
________________________________________________________________________。
B―→C的化学方程式为
________________________________________________________________________
________________________________________________________________________。
B―→A的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(3)上述A、B、C、D四种物质还原性最强的是____________(填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
合理使用药物有利身心健康.下列有关说法错误的是( )
A.氢氧化铝用于治疗胃酸过多
B.维生素C可用于治疗感冒
C.非处方药都无毒副作用,可长期大量服用
D.阿司匹林用于解热镇痛
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,在恒容密闭容器中,发生化学反应X(g)+2Y(g)⇌2Z(g).下列说法中:
①X、Y、Z的物质的量之比1:2:2;
②X、Y、Z的浓度不再发生变化;
③容器中的压强不再发生变化;
④单位时间内生成n molZ,同时生成2n mol Y,
一定达到化学平衡状态的是( )
A.②③ B.①④ C.①② D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇的研究成为当代社会的热点.
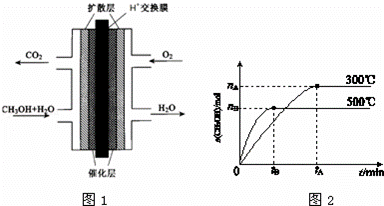
Ⅰ.甲醇燃料电池(DNFC)被认为是21世纪电动汽车最佳候选动力源.
(1)101kP a时,1mol CH3OH完全燃烧生成稳定的氧化物放出热量726.51kJ/mol,则甲醇燃烧的热化学方程式为 .
(2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0kJ•mol﹣1
②CH3OH(g)+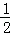 O2(g)=CO2(g)+2H2(g)△H2
O2(g)=CO2(g)+2H2(g)△H2
已知H2(g)+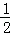 O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
O2(g)=H2O(g)△H=﹣241.8kJ•mol﹣1
则反应②的△H2= kJ•mol﹣1.
(3)甲醇燃料电池的结构示意图如图1.甲醇进入 极(填“正”或“负”),正极发生的电极反应为 .负极发生的电极反应为 .
Ⅱ.一定条件下,在体积为3L的密闭容器中反应CO(g)+2H2(g)⇌CH3OH(g)达到化学平衡状态.
(1)该反应的平衡常数表达式K= ;根据图2,升高温度,K值将 (填“增大”、“减小”或“不变”).
(2)500℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是 mol•L﹣1•min﹣1(用nB、tB表示).
(3)判断该可逆反应达到化学平衡状态的标志是 (填字母).
a.v生成(CH3OH)=v消耗(CO) b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变 d.CO、H2、CH3OH的浓度均不再变化
(4)300℃时,将容器的容积压缩到原来的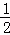 ,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
,在其他条件不变的情况下,对平衡体系产生的影响是 (填字母).
a.c(H2)减少 b.正反应速率加快,逆反应速率减慢
c.CH3OH 的物质的量增加 d.重新平衡时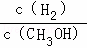 减小.
减小.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com