
分子式为C5H8O2 的有机物,能使溴的CCl4 溶液褪色,也能与NaHCO3 溶液反应生成气体,则符合上述条件的同分异构体(不考虑立体异构)最多有
A.5种 B.6种 C.7种 D.8种
科目:高中化学 来源:2016届浙江省高三上学期月考(三)化学试卷(解析版) 题型:选择题
下列有关实验装置进行的相应实验,能达到实验目的的是( )
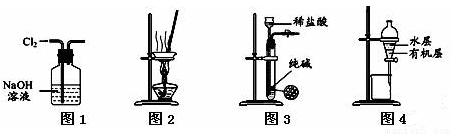
A.用图1所示装置除去Cl2中含有的少量HCl
B.用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C.用图3所示装置制取少量纯净的CO2气体
D.用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.食物在常温下腐败是自发进行的 B.凡是放热反应都是自发的
C.自发反应都是熵增大的反应 D.电解池的反应属于自发反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高一上学期期中测试化学试卷(解析版) 题型:选择题
已知aAm+与bBn-具有相同的核外电子排布,则下列关系正确的是
A. a=b+m+n B. a=b-m+n C. a=b+m-n D. a=b-m-n
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省高三上学期期中联考化学试卷(解析版) 题型:选择题
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
查看答案和解析>>
科目:高中化学 来源:2016届江苏省淮安市高三上学期10月阶段测化学试卷(解析版) 题型:实验题
二氧化氯(ClO2黄绿色易溶于水的气体)是高效、低毒的消毒剂,回答下列问题:
(1)工业上可用KC1O3与Na2SO3在H2SO4存在下制得ClO2,该反应氧化剂与还原剂物质的量之比为 。
(2)实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制各ClO2:


己知:NCl3中Cl元素化合价为+1价,具有强氧化性
①电解时发生反应的化学方程式为 。
②溶液X中大量存在的阴离子有 。
③除去ClO2中的NH3可选用的试剂是 (填标号)。
A、水 B、碱石灰 C、浓硫酸 D、饱和食盐水
(3)用下图装置可以测定混合气中ClO2的含量:
I、在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
II、在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
III、.将一定量的混合气体通入锥形瓶中吸收;
IV、将玻璃液封装置中的水倒入锥形瓶中;
V、用0.1000 mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I- +S4O62-),指示剂显示终点时共用去20.00mL硫代硫酸钠溶液。在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为 。
②玻璃液封装置的作用是 。
③V中加入的指示剂通常为 ,滴定至终点的现象是 。
④测得混合气体中ClO2的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川市高三上学期统练(三)化学试卷(解析版) 题型:选择题
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
A.加入5mL盐酸再进行滴定 B.返滴一滴待测盐酸
C.重新进行滴定 D.以上方法均不适用
查看答案和解析>>
科目:高中化学 来源:2016届江西省南昌市高三上学期第三次考试化学试卷(解析版) 题型:填空题
H、C、N、O、Fe、Si、I是中学化学中常见的元素,请根据题意回答与这些元素有关的问题:
(1)根据元素周期律,碳的非金属性强于硅,请用一个化学反应方程式表示___________________。
(2)若FeSO4和O2的系数比为2:1,试配平下列方程式:__FeSO4+__K2O2→__K2FeO4+__K2O+__K2SO4+__O2↑
(3)各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:NO2+NO+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3― 0.02mol。
①所得溶液中NaNO2的物质的量为 mol;
②混合气体中V(NO):V(NO2)= 。
(4)向FeI2溶液中不断通入Cl2,溶液中I-、I2、IO3-、Fe2+、Fe3+等粒子物质的量随n(Cl2)/n(FeI2)的变化可用下图简单表示
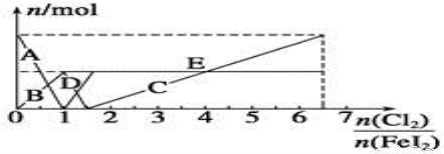
①当n(Cl2)∶n(FeI2)=6.5时,溶液中n(Cl-)∶n(IO3-)= 。
②当n(Cl2)∶n(FeI2)=1.2时,离子方程式可表示为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高二上学期期中考试化学试卷(解析版) 题型:实验题
现使用酸碱中和滴定法测定市售白醋(CH3COOH)的总酸量(g/100 mL)。
Ⅰ.实验步骤:
(1)量取10.00 mL食用白醋,在烧杯中用水稀释后转移到100 mL________(填仪器名称)中
定容,摇匀即得待测白醋溶液。
(2)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(3)读取盛装0.100 0 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
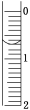
(4)滴定。滴定终点的现象是__________________________________________。
Ⅱ.数据记录:
滴定次数 | 1 | 2 | 3 | 4 |
V(样品) (mL) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) (mL) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理:
某同学在处理数据时计算得:
平均消耗的NaOH溶液的体积V=(15.95+15.00+15.05+14.95)/4 mL=15.24 mL。
(5)指出他的计算的不合理之处:__________;按正确数据处理,可得市售白醋总酸量=_____g/100 mL。(结果保留四位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com