
��1����������������ʱ������N2��O2��Ӧ������NOx����Ⱦ��������������NO�������仯ʾ��ͼ��ͼ1��
�ٸ÷�Ӧ���Ȼ�ѧ����ʽΪ
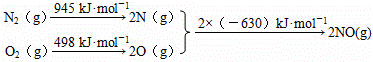 ��N2��g��+O2��g��=2NO��g����H=+184kJ•mol��1����
��N2��g��+O2��g��=2NO��g����H=+184kJ•mol��1����
�ڸ���ͼ1��ʾ��ֻ�ı�����R����N2��ת���ʴ�a3��a1ʱ��ƽ�ⳣ��K��AC����
A���������� B��һ������ C�����ܲ��� D�����ܼ�С E������С��������п���
��2�����أ��ֳ�̼�������Ǻ�������ߵĵ��ʣ���ҵ������CO2��NH3��һ�������ºϳ����صķ�Ӧ��Ϊ��
��һ����2NH3��g��+CO2��g��⇌H2NCOONH4����������泥� ��l��
�ڶ�����H2NCOONH4��l��⇌H2O��g��+H2NCONH2��l��
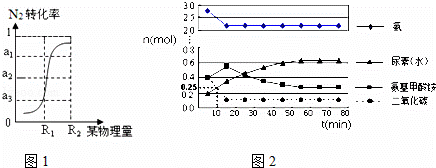
ijʵ��С��ģ�ҵ�Ϻϳ����ص���������һ���Ϊ500L���ܱ�������Ͷ��4mol����1mol������̼������
��Ӧ�и���ֵ����ʵ�����ʱ��ı仯��ͼ2��ʾ��
�ٺϳ������ܷ�Ӧ�Ŀ����ɵڡ���������Ӧ������
�ڷ�Ӧ���е�10minʱ���CO2�����ʵ�������ͼ��ʾ������CO2��ʾ�ĵ�һ����Ӧ������v��CO2��=��1.5��10��4��mol/��L•min����
���ɰ�������狀�CO2���߱仯�ɵó�����Ũ�ȱ仯��ƽ��״̬�����������ǣ�a�������������Ũ��������15min���С����b��15minʱ��һ����Ӧ�ﵽƽ��״̬��55min�ڶ�����Ӧ�ﵽƽ��״̬����
| ���ʵ�����Ũ����ʱ��ı仯���ߣ��Ȼ�ѧ����ʽ���û�ѧƽ�ⳣ�����м��㣮. | |
| ������ | ��1���ٸ��������仯ͼ���㷴Ӧ�ȣ���Ӧ��=��Ӧ��ļ��ܺͩ�������ļ��ܺͣ��Ӷ���д�Ȼ�ѧ����ʽ�� ��ƽ��������Ӧ�����ƶ�����N2��ת�������ɲ��õķ���Ϊ�����¶Ȼ����������������� ��2������֪�ܷ�Ӧ�Ŀ���������һ�����������ͼ��仯���ƽ����жϣ���Ӧ�����������ݵ�һ���͵ڶ�����Ӧ������б�ʱȽϴ�С�� �ڷ���ͼ�����10����ʱ������̼���������ʵ�������ϻ�ѧ��Ӧ���ʸ�����м��㣻 �۷���ͼ�����ߵı仯���������������ʱ��仯��15min���ʵ�������֮���С��15minʱ��һ����Ӧ�ﵽƽ��״̬��55min������������ʵ������ٱ仯���ڶ�����Ӧ�ﵽƽ��״̬�� |
| ��� | �⣺��1���ٸ÷�Ӧ�еķ�Ӧ��=��Ӧ��ļ��ܺͩ�������ļ��ܺ�=��946+498��kJ/mol��2��630kJ/mol=+184kJ/mol������N2��O2��Ӧ����NO���Ȼ�ѧ��Ӧ����ʽΪN2��g��+O2��g��=2NO��g����H=+184kJ•mol��1�� �ʴ�Ϊ��N2��g��+O2��g��=2NO��g����H=+184kJ•mol��1�� ��ֻ�ı�����R����N2��ת���ʴ�a3��a1ʱ��ƽ��������Ӧ�����ƶ�����N2��ת�������ɲ��õķ���Ϊ�����¶�K�������������������K���䣬��ѡ��A��C�� ��2������ͼ���֪��15�������ң������Ͷ�����̼��Ӧ���ɰ�������狀��ٱ仯���������ǵ�һ����Ӧ������������������ټ�С���ﵽƽ�⣬�������ǵڶ�����Ӧ��������б�ʲ��ѿ����ڶ�����Ӧ����������֪�ܷ�Ӧ�Ŀ���������һ���������ʺϳ������ܷ�Ӧ�Ŀ����ɵڶ��������� �ʴ�Ϊ������ ������ͼ�������������̼�ٽ��е�10minʱ���ʵ���Ϊ0.25mol�����Դ�ʱ�ķ�Ӧ����Ϊ= �ʴ�Ϊ��1.5��10��4�� �۷���ͼ�����ߵı仯��������������ʵ�����ʱ��仯����15min���ʵ������֮���С����ͼ�а������ʵ������䣬15minʱ��һ����Ӧ�ﵽƽ��״̬��55min������������ʵ������ٱ仯���ڶ�����Ӧ�ﵽƽ��״̬�� �ʴ�Ϊ�����������Ũ��������15min���С��15minʱ��һ����Ӧ�ﵽƽ��״̬��55min�ڶ�����Ӧ�ﵽƽ��״̬�� |
| ������ | ���⿼�����Ȼ�ѧ����ʽ�ļ����������ѧ��Ӧ���ʡ�ƽ�ⳣ���ͻ�ѧƽ��״̬�ķ����жϣ���Ҫ��ͼ��仯�ķ���Ӧ�ã����ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ� |
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ���ܺ���Cl����SO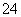 ��CO
��CO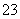 ��NH
��NH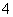 ��Fe3����Al3����K����ȡ����Һ 100 mL���������NaOH��Һ�����ȣ��õ�0.02 mol���壬ͬʱ�������ɫ���������ˣ�ϴ�ӣ����գ��õ�1.6 g���壻��������Һ�м�����BaCl2��Һ���õ�4.66 g����������ij������ɴ˿�֪ԭ��Һ��
��Fe3����Al3����K����ȡ����Һ 100 mL���������NaOH��Һ�����ȣ��õ�0.02 mol���壬ͬʱ�������ɫ���������ˣ�ϴ�ӣ����գ��õ�1.6 g���壻��������Һ�м�����BaCl2��Һ���õ�4.66 g����������ij������ɴ˿�֪ԭ��Һ��
A�����ٴ���5������ B��Cl��һ�����ڣ���c(Cl��)��0.4 mol·L��1
C��SO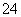 ��NH
��NH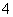 һ�����ڣ�Cl�����ܲ����� D��CO
һ�����ڣ�Cl�����ܲ����� D��CO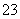 ��Al3��һ�������ڣ�K�����ܴ���
��Al3��һ�������ڣ�K�����ܴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ۺ���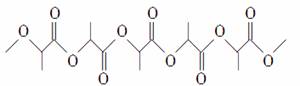 (�ṹ��ʽ)�ɱ��������գ�����Ϊ��Ʒ�������IJ��ϣ��������������������ʾۺ϶���(����)
(�ṹ��ʽ)�ɱ��������գ�����Ϊ��Ʒ�������IJ��ϣ��������������������ʾۺ϶���(����)
A��CH3CH(OH)COOH
B��HCOOCH2OH
C��HOCH2CH2COOH
D��HOCH(CH3)COOCH(CH3)CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ͭ(��)��ؾ���{K2[Cu(C2O4)2]��2H2O}�Ʊ��������£�
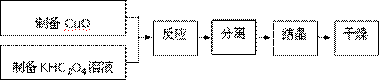
��1���Ʊ�CuO��CuSO4��Һ�е���NaOH��Һ��������С���ȴ��˫����ֽ���ˡ�ϴ�ӡ�
�ٹ�������IJ���������
��������ˮϴ������ͭʱ�����֤������ͭ��ϴ�Ӹɾ�
(2)��Ϊ���CuO�������ʣ�����ֽ�ϵ�CuO���ת�Ƶ��ȵ�KHC2O4��Һ�У����·�����ȷ����
a.������ֽ�����뵽�ȵ�KHC2O4��Һ�У�����ַ�Ӧ����ȹ���
b.��ϡ�����ܽ���ֽ�ϵ�����ͭ��Ȼ����Һת���ȵ�KHC2O4��Һ��
c.������������Һ�ܽ�����ͭ����ת���ȵ�KHC2O4��Һ��
d.�ڿ�����������ֽ����ʣ��Ĺ���ת���ȵ�KHC2O4��Һ
��50��ˮԡ��������Ӧ��֣�������Ӧ�Ļ�ѧ����ʽΪ ���پ����ȹ��ˡ���ˮϴ�ӡ�����Һ����Ũ���õ��������ͭ(��)��ؾ��塣
��3����ʵ����K2CO3��ĩ�������Һ��Ӧ�Ʊ�KHC2O4���˷�Ӧ���е���Ҫԭ���� ��
��4���������ͭ(��)��ؾ�����Ʊ�Ҳ������CuSO4�����K2C2O4��Һ��Ӧ�õ���������ͭ��Һ�л������ͭ�����ʵ�鲽��Ϊ�����������Ҵ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ����
�ټ��������Ҵ����ŵ��У�
a�����̼��ȵ�ʱ�䣬�����ܺģ� b�� ��
��������Ũ���ij�ʼ�λ�����������IJ�������Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����£���pH=10�İ�ˮ���ԣ�����˵����ȷ���ǣ�������
| �� | A�� | ��Һ����ˮ�����������Ũ��Ϊ10��4 |
| �� | B�� | ��pH=4������������Ϻ�c��Cl������c��NH4+�� |
| �� | C�� | ͨ��һ������������Ȼ����c��NH4+��+c��H+��=c��OH���� |
| �� | D�� | ��ˮ�д��ڣ�c��NH3•H2O����c��NH4+����c��OH������c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ʽ������[Fe(OH)SO4]��һ��������ˮ����������Ч����������ҽҩ��Ҳ���������������������Ѫ����ҵ�����÷���м�����������������������ȣ�������ʽ�������Ĺ����������£�
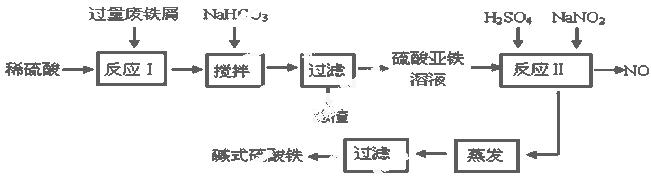
��֪������������������������ʽ����ʱ��Һ��pH���±���
| ������ | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 |
��1����������NaHCO3��Ŀ���ǵ���pH�� ��Χ�ڣ�ʹ��Һ�е� ����(д���ӷ���)��
��2����Ӧ���м���NaNO2��Ŀ���� ������Ӧ�����ӷ���ʽΪ
��3����ʵ�������У���Ӧ��ͬʱͨ��O2�Լ���NaNO2�������������뷴Ӧ��O2��11.2 L����״���������൱�ڽ�ԼNaNO2�����ʵ���Ϊ ��
��4����ʽ����������ˮ�������Fe(OH)2+���ӣ�Fe(OH)2+�ɲ���ˮ������Fe2(OH)42+ �ۺ����ӣ���ˮ�ⷴӦ�����ӷ���ʽΪ
��5����ҽҩ�ϳ����������������ᡢ����Ļ��Һ��Ӧ�Ʊ���ʽ�������������ҹ�����������Ʒ�в��ú���Fe2+��NO3����Ϊ�������ò�Ʒ���Ƿ���Fe2+��Ӧʹ�õ�����Լ�Ϊ ��
A����ˮ B��KSCN��Һ C��NaOH��Һ D������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�±�����ʾ���ʻ�����Ĵ�����ϵ������ͼ����
| X | Y | Z | |
| A�� | ��Ԫ�� | ����Ԫ�� | ������Ԫ�� |
| B�� | ����� | ������ | ������ |
| C�� | �������� | ���� | ��ɢϵ |
| D�� | �û���Ӧ | ������ԭ��Ӧ | ���ȷ�Ӧ |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�йص����ʵ�������ȷ���� (����)
A����������Һ�У�����Ũ���������Һ�г�����������ˮ��������ܽ�
B��������������Ȼ�߷��ӻ�����
C�������ʵķ���������Ĥ
D�������ʸ�Ũ��������ʱ�ʻ�ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵������ȷ����(����)
A������������1�������ɸ�CH2ԭ���ŵ����ʻ���Ϊͬϵ��
B����Է���������ͬ���л�����ͬ���칹��
C��̼ԭ��֮��ֻ�Ե������ϵ�����Ϊ����
D������ʽ��ͬ�л���һ����ͬһ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com