
��Щ���ӷ���ʽ�ܱ�ʾһ�෴Ӧ����Щ���ӷ���ʽȴֻ�ܱ�ʾһ����Ӧ���������ӷ���ʽ�У�ֻ�ܱ�ʾһ����ѧ��Ӧ����
�� Fe��Cu2��===Fe2����Cu �� Ba2����2OH����2H����SO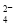 ===BaSO4����2H2O
===BaSO4����2H2O
�� Cl2��H2O===H����Cl����HClO �� CO ��2H��===CO2����H2O
��2H��===CO2����H2O
�� Ag����Cl��===AgCl��
A��ֻ�Т� B���ڢ� C���ۢ� D���٢�

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�߶���ѧ��4�½β��Ի�ѧ�Ծ��������棩 ���ͣ������
25��ʱ��ij��HA��Ka=1��0��10-7����֪����Һ�����AG=lg[c(H+)/c(OH-)]
��1��HA�ĵ��뷽��ʽΪ ��
��2��0��1 mol��L��1HA��Һ�У�c(H+)= ��AG= ��
��3������25�棬���з�����ʹHA��Һ�ĵ���ȡ���ҺpH��������� ������ĸ��
A����ˮϡ�� B����������NaA���� C��������NaOH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�콭��ʡ�Ͼ��и���9��ѧ����о���ѧ�Ծ��������棩 ���ͣ��ƶ���
��15�֣����������һ�����Ƹ�Ѫѹ��ҩ����м��壬����ͨ�����·����ϳɣ�

��ش��������⣺
��1����������еĺ���������Ϊ�ͣ������ƣ���
��2����Ӧ���м�����Լ�X�ķ���ʽΪC2H5OCl��X�Ľṹ��ʽΪ��
��3���������٢ڢ�������Ӧ�У�����ȡ����Ӧ���ǣ�����ţ���
��4��B��һ��ͬ���칹����������������
���ܷ���������Ӧ ������FeCl3��Һ������ɫ��Ӧ
��������4�ֲ�ͬ��ѧ�������⣬��1 mol������������Ʒ�Ӧ���� 1 mol H2��
д��һ�ָ�ͬ���칹��Ľṹ��ʽ����
��5����������֪ʶ�������Ŀ���������Ϣ��д����CH3OH�� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã����ϳ�·������ͼʾ�����£�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ������
��17�֣������ε�ⷨ��õĴ�����һ�����Ľ����ƺ���������Щ���ʿɲ��ô�����������ȥ��
������β��������������ڸֲĶ����������������£�
|
|
��ע��NaCl�۵�Ϊ801 �棻AlCl3��181 ��������
��1�� ����ǰ������������������������ʯӢɰ����ֹ����ʱ���Ƿֱ����������û���Ӧ�����µ����ʣ���صĻ�ѧ����ʽΪ��
�� ________________________________________________________________________
�� ________________________________________________________________________��
��2�� ��Cl2����ͨ�������еĴ������壬�����������ϸ���ȥ�����ݵ���Ҫ�ɷֳ�Cl2�����_________����̬����ճ���������ϣ�����������γɸ����������п϶�����__________��
��3�� ���÷ϼ�Һ��������A�Ĺ����У���������Ӧ�����ӷ���ʽΪ��_____________________________
__________________________________________________________________��
��4�� ���������У�������Ϊ________���������ε��Һ����Ԫ�غ���Ԫ����Ҫ��AlCl ��Al2Cl
��Al2Cl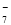 ��ʽ���ڣ����缫����Ҫ�缫��ӦʽΪ_____________________________________��
��ʽ���ڣ����缫����Ҫ�缫��ӦʽΪ_____________________________________��
��5�� �ֲĶ��������γɵ�����������Ĥ�ܷ�ֹ�ֲĸ�ʴ����ԭ����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ���������������
A������ʪ��pH��ֽ��ϡ����Һ��pH���ⶨֵƫС
B��������ƿ������Һ������ʱ���ӿ̶��ߣ�������ҺŨ��ƫС
C���ζ�ǰ�ζ����������ݣ��յ����ʱ�����ݣ��������ƫС
D���ⶨ�кͷ�Ӧ�ķ�Ӧ��ʱ��������������У������¶�ֵƫС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015����������и�����ѧ�ڵ�һ���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����ѡ�õ������������ʵ��Ҫ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫������ѧ����8�¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ������������۾���ȷ����
��� | ʵ����� | ʵ������ | ��������� |
A | ͭ��Ũ���ᷴӦ������������ʪ��KI-������ֽ���� | ��ֽ���� | NO2Ϊ�������� |
B | ��ij��Һ�м���ϡ�����ữ��BaCl2��Һ | �а�ɫ�������� | �ó���������BaSO4������Һ�п��ܺ���SO42�� |
C | ��ױ��е�������Ũ��ˮ�������� | ��Һ�ֲ㣬�ϲ�ʳȺ�ɫ���²㼸����ɫ | �ױ�����ˮ����ȡ����Ӧ��ʹ��ˮ��ɫ |
D | ��ϡAgNO3��Һ���ȼ������0.1mol/L NaCl��Һ,�ټ�������0.1mol/L NaI��Һ | �Ȳ�����ɫ����������ֻ�ɫ���� | ˵��Ksp(AgCl)��Ksp(AgI) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�ع��и�����һ��ģ�⿼�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ�������ֵ�������й�˵����ȷ����
A����״���£�22.4 LCH4��CH3CH2OH�Ļ��������������ΪNA
B�����³�ѹ�£�16 g14CH4����������ĿΪ8 NA
C��0.2 mol��Na2O2��ˮ��ȫ��Ӧת�Ƶĵ�����Ϊ0.2 NA
D��0.1 L 3 mol��L-1��NH4NO3��Һ�к��е�NH4+��ĿΪ0.3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015��㶫ʡ�����и�����ѧ�ڵ�һ��������⻯ѧ�Ծ��������棩 ���ͣ������
��16�֣�ˮú����CO ��H2������Ҫȼ�Ϻͻ���ԭ�ϣ�����ˮ����ͨ�����ȵ�̿���Ƶã�
C (s) + H2O(g)  CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1
CO (g) +H2 (g) ��H�� +131.3 kJ?mol��1
��1���÷�Ӧ��ƽ�ⳣ��K���¶ȵ����߶�___________������ / ��С / ���䣩��
��2��������Ӧ�ﵽƽ�����ϵ�е�C (s)ȫ�����ߣ�ƽ��_______________�������� / ������ / ���ƶ�����
��3��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬����_______������ţ���
A����λ�����ÿ����1 mol CO��ͬʱ����1molH2
B��������������ʵ������ֲ���
C������H2O(g)������������CO���������
D��H2O(g)��CO��H2��Ũ�����
��4��������Ӧ��t0ʱ�̴ﵽƽ�⣨����ͼ��������t1ʱ�̸ı�ijһ������������ͼ�м�������t1ʱ��֮��c(CO)��ʱ��ı仯��

�� ��С�����������ʵ�߱�ʾ����
�� �����¶ȣ������߱�ʾ����
��5��ij�¶��£���6.0 mol H2O(g)��������̿����2 L���ܱ������У��������·�Ӧ��
C (s) + H2O(g)  CO (g) +H2 (g)���ﵽƽ��ʱ���lgK= -1.0������¶���H2O(g)��
CO (g) +H2 (g)���ﵽƽ��ʱ���lgK= -1.0������¶���H2O(g)��
ת���ʣ�����������3λ��Ч���֣�Ҫ��д��������̣���
��6����֪���� C (s) + H2O(l)  CO (g) +H2 (g) ��H1
CO (g) +H2 (g) ��H1
�� 2CO(g) + O2(g) �� 2CO2 (g) ��H 2
�� H2O (l)�� H2 (g) +1/2 O2 (g) ��H 3
��2C (s) + O2 (g) �� 2CO2 (g)�ġ�H �� _________ ____��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com