
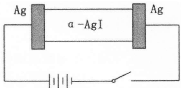
 α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )
α-AgI是一种固体导体,导电率很高.为研究α-AgI到底是Ag+导电还是I-导电,设计了如下实验,下列有关说法不正确的是( )| A、若α-AgI是Ag+导电,则通电一段时间后晶体质量不变 |
| B、若α-AgI是Ag+导电,则通电一段时间后晶体质量减少 |
| C、阳极反应为:Ag一e-=Ag+ |
| D、阴极质量不断增加 |


科目:高中化学 来源: 题型:
 已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色.A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物.它们之间的转化关系如图.反应②在工业上可用于制作印刷电路板.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )| A、a为负极,b为正极 |
| B、a为阳极,b为阴极 |
| C、电解过程中,氯离子浓度不变 |
| D、电解过程中,d电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、正极反应为:Zn-2e-=Zn2+ |
| B、一段时间后铜片增重,盐桥中K+移向CuSO4溶液 |
| C、电子从铜片经导线流向锌片 |
| D、电池工作时Zn2+和Cu2+的浓度保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=1 盐酸为介质 |
| B、pH=3 硫酸为介质 |
| C、pH=5 次氯酸为介质 |
| D、pH=12 氢氧化钠为介质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液中:Na+、[Al(OH)4]-、K+、NH4+ |
| B、由水电离出的c(H+)=10-12mol?L-1的溶液中:C1-、HCO3-、NH4+、SO32- |
| C、加入铝能离出H2的溶液中:Mg2+、NH4+、Cl-、SO42- |
| D、滴加石蕊试液显蓝色的溶液:K+、Ba2+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、恒温时,向水中加入少量固体硫酸氢钠,c(H+)增大,水的离子积常数Kw不变 |
| B、0.1mol/LCH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C、对于N2(g)+3H2(g)=2NH3(g),其他条件不变,充入N2,正反应速率增大,逆反应速率减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液,振荡、过滤、洗涤,沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol Cl2与水反应转移的电子数为NA |
| B、标准状况下,11.2L CCl4含有的分子数约为0.5NA |
| C、常温常压下,32g O2和O3的混合物中含有原子数为2NA |
| D、1L 0.1mol?L-1 Al2(SO4)3溶液中Al3+的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com