
【题目】LiCoO2是锂离子电池常用的电极材料。利用原钴矿(含Cr2O3、NiS等杂质)制备LiCoO2的工艺流程如图:
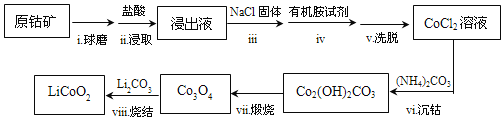
资料:①在含一定量Cl-的溶液中,钻离子以CoCl![]() 形式存在:Co2++4Cl-
形式存在:Co2++4Cl-![]() CoCl
CoCl![]()
②CoCl![]() 溶于有机胺试剂,有机胺不溶于水。
溶于有机胺试剂,有机胺不溶于水。
③盐酸溶液中,有机胺试剂对金属离子的溶解率随盐酸浓度变化如图所示:
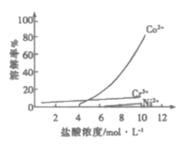
(1)步骤ⅱ选用盐酸的浓度应为___,该过程要注意在通风橱中进行的原因为___(用离子方程式表示)。
a.4mol/L b.6mol/L c.10mol/L
(2)从平街移动角度解释步骤中加入NaCl固体的目的___。
(3)步骤ⅳ的操作是___。
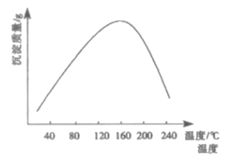
(4)步骤ⅵ用(NH4)2CO3作沉淀剂,在一定条件下得到碱式碳酸钻Co2(OH)2CO3]。已知碱式碳酸钻在339℃以上开始分解,实验测得在一段时间内加入等量(NH4)2CO3所得沉淀质量随反应温度的变化如图所示。分析曲线下降的原因___。
(5)步骤ⅷ中Co3O4和Li2CO3混合后,鼓入空气,经高温烧结得到LiCoO2。该反应的化学方程式是___。
(6)多次实验测定该原钴矿中钴元素的质量分数为1.18%,则原钴矿中Co2O3的质量分数为___%。(假设原钻矿中含钻元素的物质只有Co2O3)。
【答案】c NiS+2H+=Ni2++H2S↑ 加入NaCl固体,溶液中Cl-浓度增大,平衡Co2++4Cl-![]() CoCl
CoCl![]() 右移,CoCl
右移,CoCl![]() 浓度增大,提高其在有机胺试剂中的浓度 分液 温度过高,碳酸铵分解(或NH
浓度增大,提高其在有机胺试剂中的浓度 分液 温度过高,碳酸铵分解(或NH![]() 和CO
和CO![]() 水解程度增大),碳酸铵浓度降低,沉淀质量减少 4Co2O3+6LiCO3+O2
水解程度增大),碳酸铵浓度降低,沉淀质量减少 4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2 1.66
12LiCoO2+6CO2 1.66
【解析】
原钴矿(含Cr2O3、NiS等杂质),球磨后加入盐酸浸取,由题给信息可知,为分离Co与Cr、Ni,加入盐酸浓度在10mol/L以上,浸出液加入氯化钠固体,CoCl42-浓度增大,提高其在有机胺试剂中的浓度,加入有机胺试剂萃取,洗脱,可得到CoCl2溶液,加入碳酸铵生成碱式碳酸钴,煅烧生成Co3O4,加入碳酸锂,可生成目标物,以此解答该题。
(1)步骤ii选用盐酸的浓度应为10mol/,可用于分离Co与Cr、Ni;由于原料中含有NiS与盐酸反应生成H2S,H2S有毒,故应在通风橱中进行,反应的离子方程式为:NiS+2H+=Ni2++H2S↑,故答案为:c;NiS+2H+=Ni2++H2S↑;
(2)步骤ⅲ中加入NaCl固体,可使溶液中Cl-浓度增大,平衡Co2++4Cl-CoCl42-右移,CoCl42-浓度增大,提高其在有机胺试剂中的浓度,故答案为:加入NaCl固体,溶液中Cl-浓度增大,平衡Co2++4Cl-![]() CoCl
CoCl![]() 右移,CoCl
右移,CoCl![]() 浓度增大,提高其在有机胺试剂中的浓度;
浓度增大,提高其在有机胺试剂中的浓度;
(3)步骤iv加入有机溶剂,用于萃取,可用分液的方法分离,故答案为:分液;
(4)由图象可知,温度升高,沉淀曲线下降,原因为温度过高,碳酸铵分解(或NH4+和CO32-水解程度增大),碳酸铵浓度降低,沉淀质量减少。(或温度过高Co2(OH)2CO3分解,沉淀质量减少。),故答案为:温度过高,碳酸铵分解(或NH![]() 和CO
和CO![]() 水解程度增大),碳酸铵浓度降低.沉淀质量减少;
水解程度增大),碳酸铵浓度降低.沉淀质量减少;
(5)Co3O4 和Li2CO3 混合后,鼓入空气,经高温烧结得到LiCoO2,方程式为4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2,故答案为:4Co2O3+6LiCO3+O2
12LiCoO2+6CO2,故答案为:4Co2O3+6LiCO3+O2![]() 12LiCoO2+6CO2;
12LiCoO2+6CO2;
(6)原钴矿中钴元素的质量分数为1.18%,则原钴矿中Co2O3的质量分数为1.18%![]() =1.66%,故答案为:1.66%。
=1.66%,故答案为:1.66%。


 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】等质量的两份锌粉a、b,分别加入两支相同的试管中,然后加入等体积等物质的量浓度且均过量的稀硫酸,同时向a中加入少量CuSO4溶液,则产生氢气的体积(V)与时间(t)的关系用图像表示如下,其中正确的是( )
A. 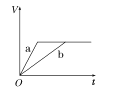 B.
B. 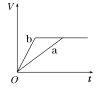 C.
C. 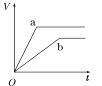 D.
D. 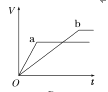
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制氯气的装置。
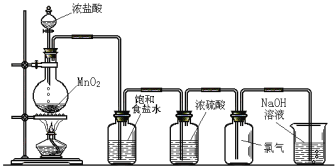
圆底烧瓶中发生反应的化学方程式为_____________________,生成1个Cl2分子转移电子数目为________个,饱和食盐水的作用是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”正成为科学家研究的主要课题。将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
(1) 已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下图:
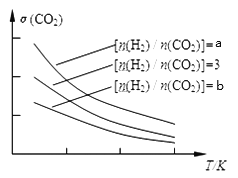
①a、3、b的大小关系___________
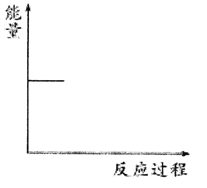
②请根据下图中信息在下图(右)中画出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的能量关系曲线___________。
(2)某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,上述反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的______
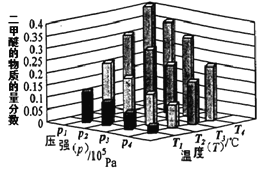
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)在恒容密闭容器里按体积比为1:3充入CO2(g)和H2(g),一定条件下上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的浓度增大
(4)下列一定能说明上述反应达到平衡的是___________
A.气体的平均摩尔质量不变
B.恒容条件下,气体的密度不变
C.各物质的速率之比等于系数比
D.[n(H2)/n(CO2)]不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:
(1)瑞德西韦是一种抗病毒药物,结构如下。

该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。
(2)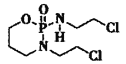 (异环磷酰胺)常用作抗癌药,1mol该物质含
(异环磷酰胺)常用作抗癌药,1mol该物质含![]() 键数目为______NA。
键数目为______NA。
(3)实验测得![]() 中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
(4)![]() 可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,
可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,![]() 的空间构型为____________。
的空间构型为____________。
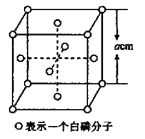
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为![]() ,晶体中白磷分子之间的最短距离为____________cm(用含
,晶体中白磷分子之间的最短距离为____________cm(用含![]() 、NA的式子表示)。
、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是

A. 电解质溶液中Na+向b极移动
B. b极的电极反应是:O2+2H2O+4e-=4OH-
C. a极是负极,发生氧化反应
D. 电子通过外电路从b电极流向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是( )
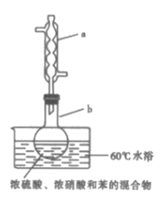
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.可用仪器a、b将反应后的混合物直接蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
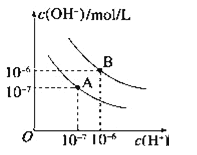
(1)95℃时水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的PH=_____.
(3)95℃时水的电离平衡曲线应为___(填“A”或“B”),请说明理由______________________.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列实验仪器和实验操作的有关问题。


(1)图A中试管夹的作用是______________________。
(2)指出图B中的错误操作是____________________________________。
(3)图C、D是某同学配制50 g质量分数为6%的氯化钠溶液时,在称量和量取两个操作步骤中出现的情况:
①如图C所示:在称量氯化钠的操作过程中,发现指针偏右,则继续进行的操作是______________,至天平平衡。
②如图D所示,量取水时,仰视读数,所得溶液中溶质的质量分数会______________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com