
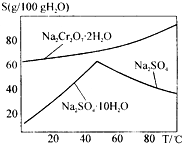
 如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)
如图是红矾钠Na2Cr2O7•2H2O和Na2SO4的溶解度曲线.现欲对两种物质进行分离,操作I的方法是先对加热后的混合溶液进行②,以得到硫酸钠晶体;然后操作II是①,得到红矾钠晶体.(填编号)分析 分析图象中溶解度随温度的变化,操作是先分离出硫酸钠晶体,再获得红矾钠,由图可知,硫酸钠的溶解度受温度影响比较大,温度高于50°C时析出的是硫酸钠固体,当温度低于50°C时析出的是硫酸钠晶体;红矾钠溶解度受温度影响变化是随温度升高增大,据此分析.
解答 解:根据图象可知,当温度高于50°C时析出的是硫酸钠固体,当温度低于50°C时析出的是硫酸钠晶体,且Na2SO4•10H2O晶体的溶解度随温度的变化很大,故操作I的方法是先对加热后的混合溶液进行降温结晶,析出Na2SO4•10H2O晶体,然后过过滤即可;剩余的滤液中为Na2Cr2O7,而红矾钠Na2Cr2O7•2H2O的溶解度随温度的变化而变化不大,故欲得到红矾钠晶体,应采取蒸发浓缩,趁热过滤的方法,故答案为:②;①.
点评 本题考查了物质制备的分离和提纯方法以及实验操作的分析应用,把握晶体析出的原理和溶解度变化特征的分析是解题关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液和氯化铜溶液 | B. | 硫酸钠溶液和氯化钠溶液 | ||
| C. | 氯化铝溶液和氢氧化钠溶液 | D. | 硫酸氢钠溶液和碳酸钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 1:4 | D. | 2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中电子式为  的分子含量过多会造成温室效应 的分子含量过多会造成温室效应 | |
| B. | 结构示意图为 的阴离子都不能破坏水的电离平衡 的阴离子都不能破坏水的电离平衡 | |
| C. | 球棍模型为  的分子可发生加成反应 的分子可发生加成反应 | |
| D. | 电子式分别为 和 和 的两种化合物均为常见的氧化剂 的两种化合物均为常见的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32% | B. | 24.2% | C. | 22.2% | D. | 16.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Fe3++SO2+2H2O→SO42-+2H++2Fe2+ | B. | I2+SO2+2H2O→H2SO4+2HI | ||
| C. | H2O2+2H++SO42-→SO2↑+O2↑+2H2O | D. | 2Fe3++2I-→2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,常用于汽水、糖果的添加剂.
,常用于汽水、糖果的添加剂.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com