
钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。已知:
SrSO4(s)  Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
Sr2+(aq)+SO42-(aq) Ksp=2.5×10-7
SrCO3(s)  Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
Sr2+(aq)+CO32-(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________,该反应的平衡常数表达式为____________;该反应能发生的原因是___________________________________________。(用沉淀溶解平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO32-的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;
②增大CO32-的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用的试剂为________;实验现象及其相应结论为____________________________。
(1)SrSO4(s)+CO32-(aq)  SrCO3(s)+SO42-(aq)? K=
SrCO3(s)+SO42-(aq)? K= ? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)
? Ksp(SrCO3)<Ksp(SrSO4),加入CO32-后,平衡SrSO4(s)  Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
Sr2+(aq)+SO42-(aq)正向移动,生成SrCO3
(2)①减小 ②不变
(3)盐酸 若沉淀完全溶解,则证明SrSO4完全转化成SrCO3,否则,未完全转化
【解析】(1)SrSO4转化成SrCO3的离子反应为:SrSO4(s)+CO32-(aq)??SrCO3(s)+SO42-(aq),根据沉淀转化的原理,该反应能够发生,是因为Ksp(SrCO3)<Ksp(SrSO4)。(2)①降低温度有利于提高SrSO4的转化率,说明降温平衡向正反应方向移动,因此升高温度,平衡向逆反应方向移动,故平衡常数K减小。②平衡常数只与温度有关,增大CO32-的浓度,平衡常数不变。(3)根据提供的信息,可以推断SrSO4难溶于盐酸,而SrCO3可溶于盐酸,因此向溶液中加入盐酸,若沉淀全部溶解,则SrSO4完全转化成SrCO3,若沉淀没有全部溶解,则SrSO4没有完全转化成SrCO3,需要注意的是,不能选择稀硫酸,因为SrCO3与稀硫酸反应生成SrSO4。


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市杨浦区高三上学期期末学业质量调研化学试卷(解析版) 题型:填空题
锶(Sr)是人体必需的微量元素,其单质和化合物的化学性质与钙、钡的相似。实验室用含碳酸锶的废渣(含SrCO3 38.40%,SrO12.62%,CaCO3 38.27%,BaCO3 2.54%,其它不溶于硝酸的杂质8.17%)制备硝酸锶粗品的部分实验过程如下:

(1)市售浓硝酸的质量分数为65%,密度为1.4g/cm3,要配制30%稀硝酸500mL,还需要查阅的数据是 ,若配制过程中不使用天平,则必须要计算的数据是 ,必须要使用的仪器是 。
已知两种盐的溶解度(g/100 g水)如下表
|
温度/℃物质 |
0 |
20 |
30 |
45 |
60 |
80 |
100 |
|
Sr(NO3)2 |
28.2 |
40.7 |
47 |
47.2 |
48.3 |
49.2 |
50.7 |
|
Ca(NO3)2·4H2O |
102 |
129 |
152 |
230 |
300 |
358 |
408 |
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:过滤、 、 、洗涤,干燥。
已知,硝酸钙能溶于有机溶剂A中。式量:Sr(NO3)2–212、Ba(NO3)2–261、Ca(NO3)2–164
(3)制得的硝酸锶粗品中含少量Ca(NO3)2、Ba(NO3)2等杂质。测定硝酸锶纯度的实验如下:称取5.39g硝酸锶样品,加入足量的有机溶剂A,经过滤、洗涤、干燥后,剩余固体5.26g,将此固体配成250 mL的溶液,取出25.00 mL,调节pH为7,加入指示剂,用浓度为0.107mol/L的碳酸钠溶液滴定至终点,消耗碳酸钠溶液22.98mL。
滴定过程的反应:Sr2++CO32-→ SrCO3↓ Ba2++CO32-→ BaCO3↓
①滴定选用的指示剂为 ,滴定终点观察到的现象为 。
②该硝酸锶粗品中,硝酸锶的质量分数为 (小数点后保留两位)。若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会 (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省济南市高三第二次模拟考试(理综)化学部分 题型:填空题
(14分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)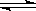 Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
SrSO3(s)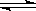 Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 。(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用试剂为 ;实验现象及其相应结论 。
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
你认为该推理是否严密?试说明理由。
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)Sr2+(aq)+SO2-4(aq)KSP=2.5×10-7
SrSO3(s)Sr2+(aq)+CO2-4(aq)KSP=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为 ,该反应的平衡常数表达式为 ;该反应能发生的原因是 。(用沉淀溶解再平衡的有关理论解释)
(2)对于上述反应,实验证明增大CO2-3的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将 ;
②增大CO2-3的浓度,平衡常数K将 。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。
实验所用试剂为 ;实验现象及其相应结论 。
(4)BaCl2溶液和Ba(NO3)2溶液是实验中检验SO2-4的常用试剂。某化学研究性学习小组检验某溶液中存在SO2-4时,首先加入Ba(NO3)2溶液,产生白色沉淀,然后加入过量稀硝酸,白色沉淀不溶解,由此得出结论:溶液中一定含有SO2-4。
你认为该推理是否严密?试说明理由。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com