
分析 (1)根据n=$\frac{N}{{N}_{A}}$计算氢氧根离子的物质的量,根据摩尔质量以g/mol为单位,数值等于其相对分子质量;
(2)根据n=$\frac{N}{{N}_{A}}$计算H2O的物质的量,每个水分子含有3个原子,每个水分子含有10个电子;
(3)根据n=$\frac{N}{{N}_{A}}$计算NH4+的物质的量,根据m=nM计算其质量.
解答 解:(1)6.02×1023个氢氧根离子的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{6.02×1{0}^{23}}{6.02×1{0}^{23}}$=1mol,氢氧根离子的相对式质量为16+1=17,其摩尔质量为17g/mol,
故答案为:1;17 g/mol;
(2)3.01×1023个H2O的物质的量为n=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}}$=0.5mol,每个水分子含有3个原子,所有的原子的物质的量为0.5mol×3=1.5mol,
每个水分子含1×2+8=10个电子,所有的电子的物质的量为0.5mol×10=5mol,
故答案为:0.5;1.5;5;
(3)1.204×1023个NH4+的物质的量n=$\frac{N}{{N}_{A}}$=$\frac{1.024×1{0}^{23}}{6.02×1{0}^{23}}$=0.2mol,质量为m=nM=0.2mol×18g/mol=3.6g,
故答案为:0.2;3.6.
点评 本题考查物质的量的计算,为高频考点,侧重学生的分析、计算能力的考查,注意把握相关计算公式的运用,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ④⑤⑥ | C. | ①②④⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 化学反应中能量变化的主要原因是化学键的断裂与生成 | |
| B. | 化石燃料是不可再生能源,燃烧时将化学能转变为热能 | |
| C. | 图I所示的装置能将化学能转变为电能 | |
| D. | 图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液:Na+、K+、SO42-、AlO2- | |
| B. | KW/c(OH-)=0.1mol/L的溶液:Na+、Mg2+、NO3-、S2- | |
| C. | 无色溶液:Na+、Ca2+、NO${\;}_{3}^{-}$、Cl- | |
| D. | 能使甲基橙呈黄色的溶液:H+、ClO-、Fe2+、Ag+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
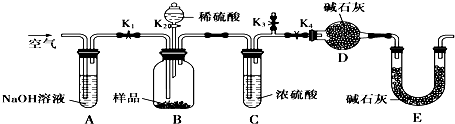
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 70% | B. | 30% | C. | 52.4% | D. | 22.2% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com