
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等。制备流程如图所示:
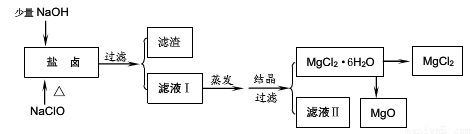
(1)滤渣的成分是______(填化学式);滤液Ⅱ中所含的主要杂质离子 (写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为________;加入NaClO还能起到的作用是______。
(3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是_____。用MgCl2·6H2O制备无水MgCl2过程中,所需要的化学试剂是________。
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_________________________________。SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是________。
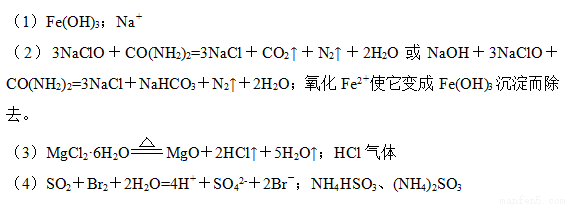
【解析】(1)滤渣的成分是Fe(OH)3;滤液Ⅱ中所含的主要杂质离子是Na+。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为3NaClO+CO(NH2)2=3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2=3NaCl+NaHCO3+N2↑+2H2O;加入NaClO还能起到的作用是氧化Fe2+使它变成Fe(OH)3沉淀而除去。
(3)直接将MgCl2·6H2O加强热能得到MgO,反应的化学方程式是MgCl2·6H2O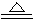 MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中,为抑制上述反应,所需要的化学试剂是HCl气体。
MgO+2HCl↑+5H2O↑。用MgCl2·6H2O制备无水MgCl2过程中,为抑制上述反应,所需要的化学试剂是HCl气体。
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是SO2+Br2+2H2O=4H++SO42-+2Br-。SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是NH4HSO3或(NH4)2SO3。


科目:高中化学 来源:2014高考名师推荐化学钠及其化合物主要性质(解析版) 题型:选择题
下列类比关系正确的是
A.钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2
B.Na2O2与CO2反应生成Na2CO3和O2,则Na2O2与SO2反应可生成Na2SO3和O2
C.Fe与Cl2反应生成FeCl3,则Fe与I2反应可生成FeI3
D.Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习4(解析版) 题型:填空题
卤族元素是典型的非金属元素,包括F、Cl、Br、I等。请回答下面有关问题
(1)同主族元素的电负性大小存在一定的规律,卤族元素F、Cl、Br、I的电负性由小到大的顺序是_____。
(2)Br原子的M层核外电子排布式为_________。
(3)用价层电子对互斥理论判断BeCl2的构型为________,BF3分子中B-F键的键角为________。
(4)CCl4分子中碳原子的杂化方式为______,NF3分子的空间构型为_______。
(5)F、Mg、K三种元素形成的晶体晶胞结构如图所示,一个晶胞中 Mg元素的质量分数为________。
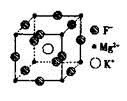
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习2(解析版) 题型:填空题
硅在地壳中的含量较高。硅及其化合物的开发由来已久,在现代生活中有广泛应用。回答下列问题:
(1)1810年瑞典化学家贝采利乌斯在加热石英砂、木炭和铁时,得到一种“金属”。这种“金属”可能是 。
(2)陶瓷、水泥和玻璃是常用的硅酸盐材料。其中,生产普通玻璃的主要原料有 。
(3)高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
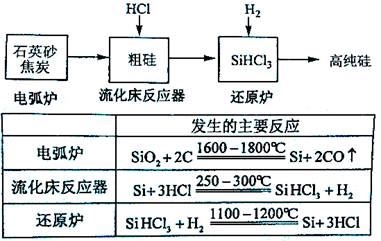
①用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为 ;碳化硅又称 ,其晶体结构与 相似。
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如下表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和 。
物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
③SiHCl3极易水解,其完全水解的产物为 。
(4)氯碱工业可为上述工艺生产提供部分原料,这些原料是 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学选做题练习1(解析版) 题型:填空题
前四周期原子序数依次增大的元素A,B,C,D中,A和B的价电子层中未成对电子均只有1个,且A-和B+的电子相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
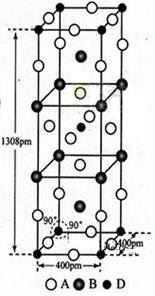
(1)D2+的价层电子排布图为_______。
(2)四种元素中第一电离最小的是________,电负性最大的是________。(填元素符号)
(3)A、B和D三种元素责成的一个化合物的晶胞如图所示。
①该化合物的化学式为_________;D的配位数为_______;
②列式计算该晶体的密度_______g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有_____;该化合物中存在一个复杂离子,该离子的化学式为_______,配位体是____。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学资源的综合应用(解析版) 题型:选择题
环境与可持续发展是现在国际的主题,利用海水是可持续发展的一个任务,对于海水的利用认识错误的是
A.海水中有大量人类需要的物质,人类可以大量开发海水中的物质,以满足资源短缺的问题
B.海水可以成为廉价的能源基地,但不能开发过度,要适度使用和开发
C.可以用太阳能电解海水以获取氢能源
D.人类在利用海水时要兼顾海洋生物和海洋生态平衡
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子的性质及检验(解析版) 题型:填空题
有一无色透明溶液,欲确定是否含有下列离子:K+、Mg2+、Al3+、Fe2+、Ba2+、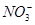 、
、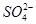 、Cl-、I-、
、Cl-、I-、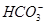 ,取该溶液进行如下实验:
,取该溶液进行如下实验:
实验步骤 | 实验现象 |
①取少量该溶液,加几滴甲基橙溶液 | 溶液变红色 |
②取少量该溶液,加入铜片和浓硫酸,加热 | 有无色气体产生,遇空气可以变成红棕色 |
③取少量该溶液,加入BaCl2溶液 | 有白色沉淀生成 |
④取③中的上层清液,加入AgNO3溶液 | 有稳定的白色沉淀生成,且不溶于稀硝酸 |
⑤取少量该溶液,加入NaOH溶液 | 有白色沉淀生成,当NaOH过量时,沉淀部分溶解 |
由此判断:
(1)溶液中一定存在的离子是 ;溶液中肯定不存在的离子是 。
(2)为进一步确定其他离子,应该补充的实验及对应欲检验离子的名称(若为溶液反应,说明使用试剂的名称,不必写详细步骤) 。
(3)写出实验⑤中所有反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学离子方程式的书写及正误判断(解析版) 题型:选择题
能正确表示下列反应的离子方程式为
A.碳酸氢钠溶液中滴入氢氧化钙溶液:HCO3-+OH-=CO32-+H2O
B.二氧化硫通入次氯酸钠溶液:SO2+ClO-+2OH-=SO42-+Cl-+H2O
C.硫化钡加入稀硫酸:BaS+2H+=H2S↑+Ba2+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学硅及其化合物主要性质、材料(解析版) 题型:选择题
下列推断正确的是
A.Mg、Al、Cu在空气中长时间放置,在其表面均生成氧化物
B.把SO2气体分别通入到BaCl2、Ba(NO3)2溶液中均有白色沉淀生成
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.SiO2是酸性氧化物,能与NaOH溶液反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com