

| 温度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |

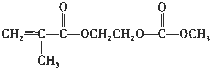 ,写出该单体与足量氢氧化钠溶液反应的化学方程式:
,写出该单体与足量氢氧化钠溶液反应的化学方程式: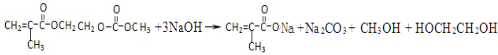 .
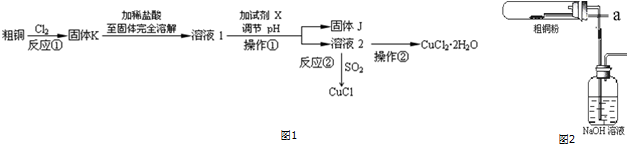
.分析 方法三:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓,冷却加水过滤得到滤液I和滤渣I,滤渣中含有Al2O3•4SiO2•H2O↓,滤液中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4;
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式;
(4)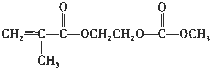 中含有酯基,能和NaOH反应生成酸式盐和醇;
中含有酯基,能和NaOH反应生成酸式盐和醇;
(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,充电时的阴极上C6Li(1-x)得电子发生还原反应,若用该电池电解精炼铜,阴极质量增重12.8g,则阴极析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,铜离子得到的电子为0.4mol,则电池中通过聚合物隔膜的Li+数目为0.4NA.
解答 解:方法三:2LiAl(SiO3)2+H2SO4(浓)$\frac{\underline{\;250-300℃\;}}{\;}$Li2SO4+Al2O3•4SiO2•H2O↓,冷却加水过滤得到滤液I和滤渣I,滤渣中含有Al2O3•4SiO2•H2O↓,滤液中含有Li2SO4、MgSO4、CaSO4,向滤液中加入NaOH、Na2CO3,镁离子和NaOH反应生成氢氧化镁沉淀,钙离子和碳酸钠反应生成碳酸钙沉淀,所以滤渣II为Mg(OH)2、CaCO3,滤液中含有硫酸锂,向滤液中加入饱和碳酸钠得到碳酸锂沉淀,铁和磷酸反应生成磷酸铁,C、磷酸铁和碳酸锂在高温下反应生成LiFePO4;
(1)在方法一所发生的反应中,除生成磷酸亚铁锂、乙酸外,还有H2O,该反应中铵根离子生成氨气、碳酸根离子生成二氧化碳,所以生成的物质中还含有的气体是CO2、NH3,故答案为:CO2、NH3;
(2)在方法二中,阳极上Fe失电子和磷酸二氢根离子、锂离子反应生成磷酸亚铁锂,电极反应式为Fe+H2PO4-+Li+-2e-=LiFePO4+2H+,
故答案为:Fe+H2PO4-+Li+-2e-=LiFePO4+2H+;
(3)在方法三中,从滤渣Ⅰ溶于酸得到铝离子,氢氧化铝不溶于弱碱但能溶于强碱,所以a为氨水,向溶液中加入氨水得到Al(OH)3沉淀,灼烧Al(OH)3沉淀得到Al2O3;
①铝离子和一水合氨反应生成Al(OH)3沉淀,离子方程式为Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
②滤渣Ⅱ的主要成分是:Mg(OH)2、CaCO3,故答案为:Mg(OH)2、CaCO3;
③在高温下生成磷酸亚铁锂,根据反应物、生成物和反应条件书写方程式为2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑,
故答案为:2FePO4+Li2CO3+2C $\frac{\underline{\;高温\;}}{\;}$2LiFePO4+3CO↑;
(4)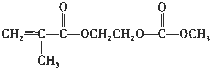 中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为
中含有酯基,能和NaOH反应生成酸式盐和醇,反应方程式为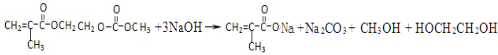 ,故答案为:
,故答案为: ;
;
(5)磷酸铁锂动力电池(简称LFP)工作原理为:C6Li+FePO4$?_{充电}^{放电}$C6Li(1-x)+(1-x)FePO4+xLiFePO4,充电时的阴极上C6Li(1-x)得电子发生还原反应,阴极反应式为C6Li(1-x)+xLi++xe-═C6Li,若用该电池电解精炼铜,阴极质量增重12.8g,则阴极析出n(Cu)=$\frac{12.8g}{64g/mol}$=0.2mol,铜离子得到的电子物质的量=0.2mol×2=0.4mol,根据电荷守恒则电池中通过聚合物隔膜的Li+数目为0.4NA,
故答案为:C6Li(1-x)+xLi++xe-═C6Li; 0.4NA.
点评 本题考查物质的分离和提纯,综合性较强,涉及原电池原理、有机物性质、物质分离和提纯试剂的选取等知识点,明确化学反应原理、物质性质及性质差异性是解本题关键,侧重考查学生分析计算及综合知识运用能力,难点是电极反应式的书写.


 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑤ | C. | 只有① | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
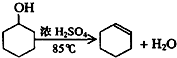
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
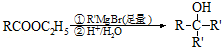
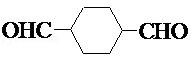 .
.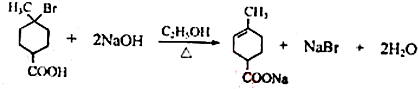 .
.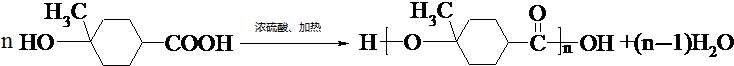 .
.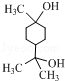 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
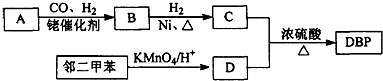

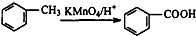
 .
. .
.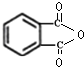 .
.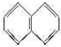 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com