
【题目】H2O2分解速率受多种因素影响。实验测得 70 ℃时不同条件下H2O2浓度随时间的变化如图所示。下列说法正确的是 ( )

A. 图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B. 图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C. 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
D. 图丙表明,少量Mn 2+存在时,溶液碱性越强,H2O2分解速率越快
【答案】C
【解析】
A项,图甲表明,其他条件相同时,H2O2浓度越大,其分解速率越快,A项错误;
B项,图乙表明,其他条件相同时,NaOH溶液的浓度越大,溶液的碱性越强,pH越大,H2O2分解速率越快,B项错误;
C项,图丙表明,其他条件相同有一定浓度的Mn2+存在时,H2O2的分解速率:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH,但不是“溶液碱性越强,H2O2分解速率越快”,碱性溶液中Mn2+对H2O2的分解速率有影响,图丁表明,其他条件相同时,Mn2+浓度越大,H2O2分解速率越快,根据上述分析,图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大,C项正确;
D项,图丙表明,其他条件相同时,H2O2的分解速率:0.1mol/LNaOH溶液>1.0mol/LNaOH溶液>0mol/LNaOH,少量Mn2+存在时,并不是“溶液碱性越强,H2O2分解速率越快”,D项错误;
答案选C。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】铁是生产生活中应用最广泛的一种金属。某化学学习小组在实验室中探究铁钉(主要成分为低碳钢)与热浓硫酸的反应。其探究流程如图所示:
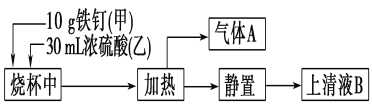
(1)从实验安全的角度考虑,应先向烧杯中加入______(填“甲”或“乙”);根据加入的反应物的量,实验需要选取的烧杯的规格为________(填字母序号)。
a.50 mL b.100 mL c.500 mL d.1 000 mL
(2)上清液B中可能既含Fe3+,又含Fe2+,要检验上清液B中有无Fe2+,应加入的试剂是________(填字母序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液
c.NaOH溶液 d.酸性KMnO4溶液
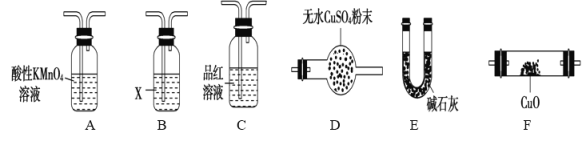
(3)气体A的主要成分是SO2,还可能含有H2和CO2。流程图中“加热”时可能生成CO2的原因是(用化学方程式表示)___________________。利用下列仪器可以同时检验气体A中是否含有H2和CO2(其中的夹持仪器、橡胶管和加热装置已经略去),则仪器的连接顺序是____________
(4)烧杯中的产物之一FeSO4有如下转化关系 (无关物质已略去)。
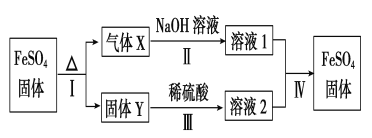
已知:①X由两种化合物组成,将X通入品红溶液,溶液褪色;通入BaCl2溶液,产生白色沉淀。②Y是红棕色的化合物。反应Ⅰ的化学方程式为_________________X通入BaCl2溶液,产生白色沉淀的化学式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是

A.溶液酸性越强,R 的降解速率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铁粉和过量2mol/L的稀H2SO4反应中,下列各措施能加快的速率,但又不影响H2的总量的是( )
A.加入少量的CuSO4溶液B.将2mol/L的稀硫酸改成98%的浓硫酸
C.将铁粉改为铁片D.加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁( FeTiO3),其中一部分Fe2+在风化过程中会转化为+3价。
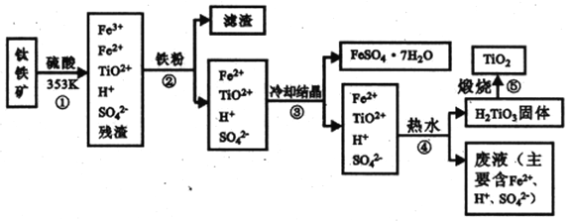
已知:TiO(OH)2(即H2TiO3)为两性氢氧化物
(1)步骤②中,发生主要反应的离子方程式为__________。
(2)步骤③中,实现混合物的分离是利用物质的__________填字母序号)。
A.熔沸点差异 B.溶解性差异 C.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是__________(填操作名称)。
(4)请结合化学用语,用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:__________。
(5)上述工艺流程中可以循环利用的物质是__________
(6)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
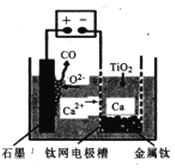
①写出阳极所发生反应的电极反应式__________。
②在制备金属Ti前后,CaO的质量将__________(填“增大”、“不变”或“减小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 44gCO2与C3H8的混合物中含有共用电子对数为9NA
B. 将标准状况下2.24LSO2通入水中完全溶解,溶液中HSO32-与SO32-总数为0.1NA
C. 硝酸与铜反应得到NO2、N2O4共23g,则铜失去的电子数为0.5NA
D. 标准状况下,8.96L的平均相对分子质量为3.5的H2与D2混合物中含中子数0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年度国家科学技术奖授予我国诺贝尔奖获得者屠呦呦,表彰她在抗疟疾青蒿素方面的研究。
(查阅资料)青蒿素熔点156~157℃,易溶于丙酮、氯仿和乙醚,在水几乎不溶。
I.实验室用乙醚提取青蒿素的工艺流程如下:

(1)在操作I前要对青蒿进行粉碎,其目的是________________
(2)操作II的名称是_____________。
(3)操作III进行的是重结晶,其操作步骤为_____ 、_____、______、过滤、洗涤、干燥
II.已知青蒿素是一种烃的含氧衍生物为确定它的化学式,进行了如下实验:

实验步骤:①连接装置,检查装置的气密性。②称量E、F中仪器及药品的质量。③取14.10g青蒿素放入硬质试管C中,点燃C、D处酒精灯加热,充分燃烧④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(4)装置E、F应分别装入的药品为_______________、___________________。
(5)实验测得:
装置 | 实验前 | 实验后 |
E | 24.00g | 33.90g |
F | 100.00g | 133.00g |
通过质谱法测得青蒿素的相对分子质量为282,结合上述数据,得出青蒿素的分子式为______。
(6)若使用上述方法会产生较大实验误差,你的改进方法是________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com